Кислотные аккумуляторы: конструкция, характеристики
Аккумулятор — источник питания, в котором при разряде энергия химической реакции преобразовывается в электрическую, а при заряде — наоборот. Главное отличие от обычной батареи – это возможность восстановления энергии методом повторной зарядки. Для заряда нужно подключить постоянный ток в направлении, обратном разряду.
Кислотные аккумуляторы были изобретены в 19 веке, но до сих пор являются самыми востребованными в мире благодаря невысокой стоимости и высокой степени эффективности. Устройство состоит из корпуса, двух разнополярных электродов, помещенных в электролит – раствор кислоты, от этого получено название – кислотные батареи (АКБ — Аккумуляторные Кислотные Батареи). По материалу, из которого изготовлены электроды, их еще называют свинцово-кислотные.

Как работают?
Основой работы аккумулятора является электрохимический процесс взаимодействия свинца и диоксида свинца в водном растворе серной кислоты. При включении нагрузки на электроды происходит химическая реакция диоксида свинца с серной кислотой H
Реакции взаимодействия, протекающие в аккумуляторе, можно описать двумя формулами:
- PbO2 + Pb + 2H2SO4 → 2PbSO4 + 2H2O – разряд.
- 2PbSO4 + 2H2O → PbO2 + Pb + 2H2SO4 — заряд.
При разрядке идет процесс образования сульфата свинца в активных массах анода и катода, расходование серной кислоты H 2SO4 и снижение плотности электролита. Во время зарядки происходят обратные реакции, идет образование серной кислоты, повышается плотность электролита. Окончание процесса заряда характеризуется завершением преобразования веществ на электродах, прекращением изменения электролита. Если продолжать зарядку, то возникает нежелательная реакция разложения воды (электролиз), идет выделение кислородных и водородных пузырьков в электролите, происходит иллюзия закипания. Если это произошло, необходимо добавить в аккумулятор дистиллированной воды для восстановления ее в электролите.
Конструкция
Кислотные батареи уже более ста лет не меняются по своему основному внутреннему устройству.
В конструкцию аккумуляторных батарей входят:
- Электроды – в виде плоских решеток из свинца, в ячейки запрессован порошок диоксид свинца (PbO2) на аноде, порошок металлического свинца (Pb) — на катоде.
- Электролит — разбавленная водой (дистиллированной) серная кислота H2SO4, в нее помещены электроды и сепаратор. Максимальная электропроводность достигается при температуре 20оС, концентрации серной кислоты – 35 %, что означает плотность электролита 1,26 г/см³. Внутренне сопротивление при этом минимально, потери внутри устройства существенно малы. В местах с низкотемпературным климатом возможно повышение плотности раствора до 1,29 г/см³ – 1,31 г/см³. Увеличение концентрации кислотного раствора препятствует замерзанию электролита, образованию льда внутри корпуса, который может повредить электроды и разорвать аккумулятор.
Основные характеристики, параметры
- Емкость (номинальная) — количество электрической энергии, которое могут дать кислотные батареи, измерение происходит в момент разряда, при нагрузке маленьким током потребления, единицы измерения— А*ч.
- Стартерный ток – показывает способность АКБ отдавать большие токи при температуре — 18 оС на протяжении половины минуты.
- Емкость(резервная) — показывает временной промежуток, на протяжении которого кислотные батареи отдают ток 25 А до величины напряжения 10,5 В.
- Нижнее значение напряжения разряженной АКБ — 1,75 — 1,8 V.
- Температурный рабочий диапазон — – 40ос — + 40оС.
Разновидности
По режиму работы кислотные батареи можно разделить на три группы:
- Циклический — принцип работы происходит по циклу – полный разряд — полный заряд, периодически отключается от источника питания. Считается наиболее жестким режимом, количество циклов стопроцентной разрядки ограничено.
- Буферный — широко используемый режим, щадящий для АКБ, при нем не допускается полного разряда, характерно постоянное подключение к источнику питания.
- Смешанный — комбинация буферного и циклических режимов, но большая часть времени работы проходит в буферном.
Самые распространенные кислотные батареи, представленные на рынке, можно разделить на виды:
| Вид | Обслуживание | Описание | Вольтаж, V |
| Lead-Acid | Обслуживаемые | Автомобильные АКБ, бывают: малосурьмянистые, сурьмянистые, кислотно-кальциевые, гибридные. | 612 |
| AGM VRLA | Не требуют обслуживания | Сепараторы изготовлены из стекловолокна, циклический и буферный режим работы. | 24612 |
| VRLA | Не требуют обслуживания | Герметичный корпус, бывают кальциевые, не выделяют газов, используются в буферном режиме. | 24612 |
| GEL VLRA | Не требуют обслуживания | В качестве электролита — селикагель, что продлевает срок службы АКБ, буферный режим эксплуатации. | 24612243648 |
| OPzV | Не требуют обслуживания | Электроды трубчатой конструкции, устойчивы к полному разряду, срок службы — около 22 лет. | 2 |
Применение
- Автотранспорт — кислотные батареи используются как стартерные батареи.
- Компьютерная техника — источники бесперебойного питания (ИБП) позволяют сохранить информацию в случае аварийного отключения электричества.
- Промышленное производство — кислотные батареи используются как источники резервного питания.
Зарядка и общие рекомендации
- Зарядку необходимо проводить при температуре 20оС.
- Ток заряда не должен превышать 10 % номинального значения емкости АКБ.
- Для использования в транспортных средствах кислотные батареи при низких температурах, лучше применять с системой внутреннего электроподогрева, т. к. емкость устройства теряется на 1% при снижении температуры на 1оС.
- Не рекомендуется хранить кислотные батареи при температуре выше 30оС, либо разряженными, предварительно АКБ должны быть полностью заряжены.
- Хранение зимой лучше организовать на холоде, т. к. процесс саморазряда будет минимален, и на плюсовую клемму необходимо предварительно нанести солидол.
- Перед использованием, кислотные батареи нужно занести в помещение с температурой 20оС на 8-10 часов для приведения в рабочее состояние.
Batareykaa.ru
Концентрация кислоты в электролите

Все ниже сказанное писалось как ответ на комментарий к моему посту Десульфатация аккумулятора зарядным IMAX B6 это реально! Хотел ответить в двух словах — не получилось, решил написать вкратце — получился огромный комментарий, по сему выделил его в отдельный пост.
Ниже описанное даст полное абстрактное понимание сути электролита автомобильного свинцового аккумулятора. По чему абстрактное — по тому что электролит это химический состав, а я не химик и пишу это не для химиков, а исключительно для обычных рядовых пользователей автомобильных аккумуляторов. Надеюсь что ниже сказанного будет достаточно для того что бы сломя голову не лить свежий электролит в разряженный аккумулятор, а постараться его правильно зарядить.

В основном электролиты для автомобильных свинцовых аккумуляторов состоят из серной кислоты h3SO4 слабой концентрации. Такой электролит и правда можно приготовить самостоятельно, зная пропорции, понизив концентрацию h3SO4 дистиллированной водой. Смысла делать это не вижу так как купить готовый электролит проще и дешевле.

На счет повышения и понижения плотности электролита — плотность зависит от количества h3SO4, то есть увеличить плотность можно как добавлением готового электролита(«кислоты»), понизить — добавлением воды(дистиллированной). В автомобильных свинцовых аккумуляторах не рекомендовано регулировать плотность без крайней необходимости.

Дело в том что кислота всегда остается в аккумуляторе и никуда не испаряется, она только переходит в другое состояние — в соли(сульфаты), в автомобильном свинцовом аккумуляторе это сульфат свинца PbSo4. Для восстановления кислоты из сульфата(восстановления плотности электролита) нужна зарядка аккумулятора, во время которой идет обратный процесс. То есть аккумулятор разряжен — плотность электролита низкая, аккумулятор зарядили — плотность повысилась, обратили процесс — восстановили «исходное», нужное количество кислоты в электролите, сульфаты стали кислотой. И именно по этой причине крайне не рекомендовано доливать электролит в аккумулятор для повышения плотности, так как в отличии от воды, которая в не значительных количествах испаряется при длительной эксплуатации аккумулятора, исходное количество кислоты всегда остается в аккумуляторе в той или иной форме.
— низкая плотность электролита = много сульфата свинца = сульфатация.
— восстановить плотность электролита = полностью зарядить аккумулятор = вернуть исходную плотность электролита = десульфатация.
Завершенный процесс зарядки аккумулятора = допустимая плотность электролита + нужное напряжение, в случаях когда плотность в процессе зарядки сильно повышается электролит нужно постепенно разбавлять дистиллированной водой, делать это нужно понемногу с постоянным контролем плотности. Это и говорит о том что часть воды испарилась в процессе эксплуатации и соответственно плотность электролита по этой причине увеличивается выше нормы.
Все это само собой не касается случаев когда электролит был, например, разлит — не плотно закрутили крышки банок, перевернули случайно и банально пролили электролит. В этом случае нужно изначально доливать дистилированной водой(!), после чего заряжать — десульфатировать, после чего либо повышать плотность корректирующим электролитом, либо заменить электролит полностью.
Процесс десульфатации свинцового аккумулятора в домашних условиях я описал вот тут «Десульфатация аккумулятора зарядным IMAX B6 это реально!», а продолжение можно почитать тут «WESTA после десульфатации IMAX B6 все еще жив!»
Спасибо за внимание и потраченное время.

Без электролитов невозможна работа перезаряжаемых источников электроэнергии. Существует несколько основных типов таких веществ, которые наиболее часто используются в современных устройствах этого типа. О том, какие существуют виды электролитов, а также каким образом можно приготовить смесь для заливки в аккумуляторную батарею, будет подробно рассказано в этой статье.
Что такое электролит и для чего он нужен
Электролит представляет собой кислотный или щелочной раствор, который принимает участие в химической реакции. Во время зарядки батареи, плотность токопроводящей жидкости повышается, поэтому по этому параметру можно довольно точно судить о степени заряженности аккумулятора.
Важно не только наличие токопроводящей жидкости в батарее, но также и качество смеси. Если приготовление раствора серной кислоты или щёлочи с водой производилось с нарушением технологии, то аккумулятор будет работать нестабильно либо полностью выйдет из строя в течение непродолжительного времени.
Виды электролита
Электролиты бывают двух основных видов:
Кислотные смеси с дистиллированной водой применяются в основном в аккумуляторах, применяемых для запуска двигателя автомобиля. Такие вещества можно приобрести в специализированных магазинах либо приготовить самостоятельно. На заводе такие смеси делают по ГОСТу, в домашних условиях также можно довольно точно соблюсти необходимые пропорции при смешивании кислоты с водой.
Щелочная смесь может быть приготовлена с использованием различных активных веществ, но наиболее часто применяется кальциево-литиевая основа, которая разводится необходимым количеством дистиллированной воды.

Кислотный электролит
Кислотную токопроводящую жидкость можно готовить самому из концентрированной серной кислоты.
Состав. В состав кислотного электролита входят два вещества:
В качестве основного вещества чаще используется серная кислота, которая практически не имеет запаха, не испаряется при комнатной температуре. По электропроводимости и другим важнейшим характеристикам этот элемент также наиболее подходит для заливки в свинцовые аккумуляторные батареи.
Особенности химических свойств. Основной характеристикой кислотного аккумулятора является его плотность. Этот параметр может существенно отличаться в зависимости от степени заряженности батареи, но не должен быть ниже 1,26 и выше 1,30 г/мм3.
Температура замерзания аккумуляторной жидкости напрямую зависит от её плотности, но если этот показатель опустится ниже минус 75 градусов Цельсия, то токопроводящая жидкость даже в полностью заряженном аккумуляторе превратится в лёд.
Серная кислота является едким веществом, поэтому при работе с этим веществом, следует использовать индивидуальные средства защиты. Как минимум, следует применять защитные очки и резиновые перчатки.
Применение. Кислотный электролит применяется, в основном, в свинцовых аккумуляторах. Такие источники тока используются в качестве стартерных батарей в легковом и грузовом транспорте.
Как приготовить. Чтобы приготовить самостоятельно потребуется следующие материалы и инструменты:
- Устойчивую к воздействую кислоты посуду и лопатку для помешивания раствора.
- Дистиллированную воду.
- Аккумуляторную серную кислоту.
Перед выполнением работы следует позаботиться о безопасности. Чтобы защититься от возможного негативного воздействия необходимо подготовить:
- Защитные очки.
- Устойчивый к кислоте фартук.
- Резиновые перчатки.
- Соду для нейтрализации действия кислоты.
Процесс приготовления осуществляется в такой последовательности:
- В ёмкость наливают необходимое количество воды.
- Тонкой струйкой добавляют концентрированную кислоту.
- Перемешать стеклянной или пластиковой лопаткой получившийся раствор.
- Дать отстояться смеси в течение 12 часов.
Для приготовления 1 литра смеси необходимой плотности потребуется 0,781 л воды и 0,285 л серной кислоты.

Щелочной электролит
Щелочной электролит имеет свои преимущества и недостатки, но такой состав также широко используется в качестве токопроводящей жидкости в портативных источниках питания.
Состав. В состав аккумуляторного электролита щелочного типа могут использоваться едкий калий или едкий натрий. Для улучшения эксплуатационных характеристик к щелочной основе добавляют также литиевые соединения. Для придания смеси текучести её разбавляют дистиллированной водой.
Особенности химических свойств. Все щелочные аккумуляторные жидкости – это сильные основания, которые активны по отношению к многим металлам и кислотам.
В результате химических реакций с кислотами образуются соль и вода. Растворы щелочей также подвергаются гидролизу. Перечисленные химические свойства позволяют использовать этот тип электропроводящей жидкости для накопления электроэнергии в аккумуляторе.
Применение. Применение щелочных растворов сводится в основном к заправке аккумуляторных батарей. Такие источники электрического тока используются в различных приборах, электропогрузчиках, а также в качестве стартерных батарей для военных машин.
Как приготовить. Чтобы приготовить щелочной электролит следует придерживаться определённых правил. Прежде всего, необходима вместительная посуда, изготовленная из устойчивого к щелочи материала. Процесс приготовления следующий:
- В ёмкость заливается необходимое количество дистиллированной воды.
- В жидкость аккуратно всыпается сухая щёлочь. Затем смесь помешивают с помощью пластмассовой лопатки.
- Производится анализ плотности. При необходимости добавить сухую смесь или воду.
- Отстаивается раствор в течение 3 часов.
- Переливается электролит в другую ёмкость, стараясь не допустить поднятия осадка со дна ёмкости.
Если вся работа была произведена по инструкции, то можно получить качественный электролит, который заливают затем в аккумуляторы подходящего типа.

Корректирующий электролит
В процессе эксплуатации обслуживаемых аккумуляторов в банки может быть случайно добавлено слишком большое количество дистиллированной воды, что приведёт к падению плотности токопроводящей жидкости ниже допустимого уровня.
Решается эта проблема приготовлением и заливкой корректирующего электролита повышенной плотности.
Состав. Состав корректирующего раствора не отличается от основного электролита. Например, дли свинцово кислотных АКБ необходимо также развести серную кислоту в дистиллированной воде, но пропорции будет немного отличаться (для получения 1 литра электролита необходимо придерживаться соотношения 0,650 л воды и 0,423 кислоты).
Особенности химических свойств. Химические свойства корректирующего электролита практически не отличаются от основной токопроводящей жидкости. Физические параметры могут незначительно отличаться (более низкая температура замерзания).
Применение. Единственное применение корректирующего электролита – это восстановление оптимальной концентрации кислоты или щёлочи внутри банок аккумулятора.
Как приготовить. Для приготовления корректирующего состава необходимо разбавить чистое основное вещество в дистиллированной воде, но добавлять его необходимо немного больше, чем при производстве обычного электролита.
Последовательность операции также не отличается от стандартной схемы работы с едкими веществами для приготовления токопроводящей жидкости для аккумулятора.

Какой электролит в какой аккумулятор заливается
Если залить в аккумулятор неподходящий электролит, то АКБ будет полностью выведена из строя. Тип аккумулятора, как правило, указан на корпусе изделия, поэтому совершенно несложно установить принадлежность источника питания к определённой категории.
Если этикетка отсутствует, то можно взять небольшое количество электролита и с помощью тестов определить его состав. В свинцово-кислотные аккумуляторы заливаются электролиты на основе серной кислоты. Для щелочных источников питания можно использовать растворы KOH и NaOH.
При добавлении электролита в щелочные устройства следует также точно определить химическую формулу применяемого основания. Отличить одну щёлочь от другой можно по цвету пламени. Если добавить в костёр KOH то цвет огня изменится на красно-фиолетовый, NaOH – горит жёлтым свечением.
Остались вопросы или есть что добавить? Тогда напишите нам об этом в комментариях, это позволит сделает материал более полным и точным.
Разбавленная и концентрированная серная кислота — это настолько важные химические продукты, что в мире их вырабатывается больше, чем любых других веществ. Экономическое богатство страны может быть оценено по объему производимой в ней серной кислоты.
Процесс диссоциации
Серная кислота находит применение в виде водных растворов различной концентрации. Она подвергается реакции диссоциации в два этапа, производя H + -ионы в растворе.
Серная кислота является сильной, и первый этап ее диссоциации происходит настолько интенсивно, что практически все исходные молекулы распадаются на H + -ионы и HSO4 -1 -ионы (гидросульфата) в растворе. Последние частично распадаются дальше, выделяя другой H + -ион и оставляя сульфат-ион (SO4 -2 ) в растворе. Однако гидросульфат, будучи слабой кислотой, все же превалирует в растворе над H + и SO4 -2 . Полная диссоциация его происходит только, когда плотность раствора серной кислоты приближается к плотности воды, т. е при сильном разбавлении.
Свойства серной кислоты
Она является особенной в том смысле, что может действовать как обычная кислота или как сильный окислитель — в зависимости от ее температуры и концентрации. Холодный разбавленный раствор серной кислоты реагирует с активными металлами с получением соли (сульфата) и выделением газа водорода. Например, реакция между холодной разбавленной Н2SO4 (в предположении ее полной двухэтапной диссоциации) и металлическим цинком выглядит так:
Горячая серная кислота концентрированная, плотность которой около 1,8 г/см 3 , может действовать в качестве окислителя, реагируя с материалами, которые обычно инертны к кислотам, такими, например, как металлическая медь. В процессе реакции медь окисляется, а масса кислоты уменьшается, образуется раствор сульфата меди (II) в воде и газообразная двуокись серы (SO2) вместо водорода, чего можно было бы ожидать при взаимодействии кислоты с металлом.

Как вообще выражается концентрация растворов
Собственно, концентрация любого раствора может быть выражена различными способами, но наиболее широко используется весовая концентрация. Она показывает количество граммов растворенного вещества в определенной массе или объеме раствора или растворителя (обычно 1000 г, 1000 см 3 , 100 см 3 и 1 дм 3 ). Вместо массы вещества в граммах можно брать его количество, выраженное в молях, – тогда получается молярная концентрация на 1000 г или 1 дм 3 раствора.
Если молярная концентрация определена по отношению не к количеству раствора, а только к растворителю, то она носит название моляльности раствора. Для нее характерна независимость от температуры.
Зачастую весовую концентрацию указывают в граммах на 100 г растворителя. Умножая этот показатель на 100 %, получают ее в весовых процентах (процентная концентрация). Именно этот способ является наиболее часто употребляемым в применении к растворам серной кислоты.
Каждой величине концентрации раствора, определенной при данной температуре, соответствует вполне конкретная его плотность (например, плотность раствора серной кислоты). Поэтому иногда раствор характеризуют именно ею. Например, раствор Н2SO4, характеризующийся процентной концентрацией 95,72 %, имеет плотность 1,835 г/см 3 при t = 20 °С. Как же определить концентрацию такого раствора, если дана только плотность серной кислоты? Таблица, дающая такое соответствие, является неотъемлемой принадлежностью любого учебника по общей или аналитической химии.
Пример пересчета концентрации
Попробуем перейти от одного способа выражения концентрации раствора к другому. Предположим, что мы имеем раствор Н2SO4 в воде с процентной концентрацией 60 %. Сначала определим соответствующую плотность серной кислоты. Таблица, содержащая процентные концентрации (первый столбец) и соответствующие им плотности водного раствора Н2SO4 (четвертый столбец), приведена ниже.
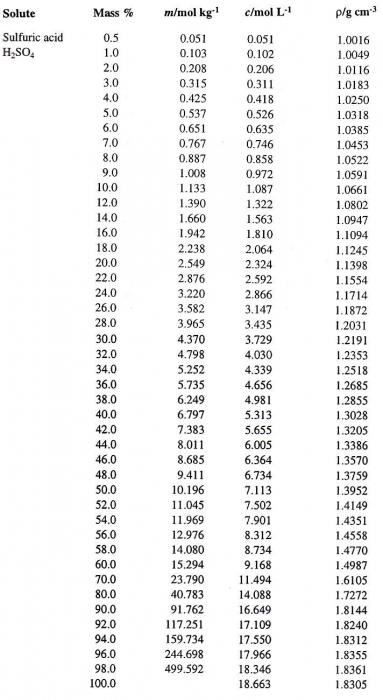
По ней определяем искомую величину, которая равна 1,4987 г/см 3 . Вычислим теперь молярность данного раствора. Для этого необходимо определить массу Н2SO4 в 1 л раствора и соответствующее ей число молей кислоты.
Объем, который занимают 100 г исходного раствора:
100 / 1,4987 = 66,7 мл.
Так как в 66,7 миллилитрах 60%-ного раствора содержится 60 г кислоты, то в 1 л ее будет содержаться:
(60 / 66,7) х 1000 = 899, 55 г.
Молярный вес серной кислоты равен 98. Отсюда число молей, содержащихся в 899,55 г ее граммах, будет равно:
899,55 / 98 = 9,18 моль.
Зависимость плотности серной кислоты от концентрации приведена на рис. ниже.

Использование серной кислоты
Она применяется в различных отраслях промышленности. В производстве чугуна и стали она используется для очистки поверхности металла, прежде чем он покрывается другим веществом, участвует в создании синтетических красителей, а также других типов кислот, таких как соляная и азотная. Она также применяется в производстве фармпрепаратов, удобрений и взрывчатых веществ, а еще является важным реагентом при удалении примесей из нефти в нефтеперерабатывающей промышленности.
Это химическое вещество является невероятно полезным и в быту, и легко доступно как раствор серной кислоты, используемый в свинцово-кислотных аккумуляторных батареях (например, тех, что стоят в автомобилях). Такая кислота, как правило, имеет концентрацию примерно от 30% до 35% H2SO 4 по весу, остальное — вода.
Для многих бытовых приложений 30% Н2SO4 будет более чем достаточно, чтобы удовлетворить свои потребности. Однако в промышленности требуется и значительно более высокая концентрация серной кислоты. Обычно в процессе производства она сначала получается достаточно разбавленной и загрязненной органическими включениями. Концентрированную кислоту получают в два этапа: сначала ее доводят до 70 %, а затем — на втором этапе — поднимают до 96-98 %, что является предельным показателем для экономически рентабельного производства.
Плотность серной кислоты и ее сорта
Хотя почти 99%-ную серную кислоту можно получить кратковременно при кипении, но последующая потеря SO3 в точке кипения приводит к снижению концентрации до 98,3%. Вообще, разновидность с показателем 98% более устойчива в хранении.
Товарные сорта кислоты различаются по ее процентной концентрации, причем для них выбраны те ее значения, при которых минимальны температуры кристаллизации. Это сделано для уменьшения выпадения кристаллов серной кислоты в осадок при транспортировке и хранении. Основные сорта таковы:
- Башенная (нитрозная) — 75 %. Плотность серной кислоты этого сорта равна 1670 кг/м 3 . Получают его т.наз. нитрозным методом, при котором получаемый при обжиге первичного сырья обжиговый газ, содержащий двуокись серы SO2, в футерованных башнях (отсюда и название сорта) обрабатывают нитрозой (это тоже H2SO4, но с растворенными в ней оксидами азота). В результате выделяются кислота и оксиды азота, которые не расходуются в процессе, а возвращаются в производственный цикл.
- Контактная — 92,5-98,0 %. Плотность серной кислоты 98%-ной этого сорта равна 1836,5 кг/м 3 . Получают ее также из обжигового газа, содержащего SO2, причем процесс включает окисление двуокиси до ангидрида SO3 при ее контакте (отсюда и название сорта) с несколькими слоями твердого ванадиевого катализатора.
- Олеум — 104,5 %. Плотность его равна 1896,8 кг/м 3 . Это раствор SO3 в H2SO4, в котором первого компонента содержится 20 %, а кислоты — именно 104,5 %.
- Высокопроцентный олеум — 114,6 %. Его плотность – 2002 кг/м 3 .
- Аккумуляторная — 92-94 %.
Как устроен автомобильный аккумулятор
Работа этого одного из самых массовых электротехнических устройств полностью основана на электрохимических процессах, происходящих в присутствии водного раствора серной кислоты.
Автомобильный аккумулятор содержит разбавленный серно-кислотный электролит, а также положительный и отрицательный электроды в виде нескольких пластин. Положительные пластины выполнены из красновато-коричневого материала — диоксида свинца (PbO2), а отрицательные — из сероватого «губчатого» свинца (Pb).
Поскольку электроды изготовлены из свинца или свинцовосодержащего материала, то этот тип батареи часто называют свинцово-кислотным аккумулятором. Работоспособность его, т. е. величина выходного напряжения, напрямую определяется тем, какова в данный момент времени плотность серной кислоты (кг/м3 или г/см 3 ), залитой в аккумулятор в качестве электролита.
Что происходит с электролитом при разряде аккумулятора
Электролит свинцово-кислотного аккумулятора представляет собой раствор аккумуляторной серной кислоты в химически чистой дистиллированной воде с процентной концентрацией по 30 % при полной зарядке. Чистая кислота имеет плотность 1,835 г/см 3 , электролит – около 1,300 г/см 3 . Когда аккумулятор разряжается, в нем происходят электрохимические реакции, в результате которых из электролита отбирается серная кислота. Плотность от концентрации раствора зависит практически пропорционально, поэтому она должна уменьшаться вследствие снижения концентрации электролита.
До тех пор, пока ток разряда протекает через аккумулятор, кислота вблизи его электродов активно используется, и электролит становится все более разбавленным. Диффузия кислоты из объема всего электролита и к электродным пластинам поддерживает примерно постоянную интенсивность химических реакций и, как следствие, выходное напряжение.
В начале процесса разряда диффузия кислоты из электролита в пластины происходит быстро потому, что образующийся при этом сульфат еще не забил поры в активном материале электродов. Когда сульфат начинает формироваться и заполнять поры электродов, диффузия происходит более медленно.
Теоретически можно продолжить разряд до тех пор, пока все кислота не будет использована, и электролит будет состоять из чистой воды. Однако опыт показывает, что разряды не должны продолжаться после того, как плотность электролита упала до 1,150 г/см 3 .
Когда плотность падает от 1,300 до 1,150, это означает, что столько сульфата было сформировано в процессе реакций, и он заполняет все поры в активных материалах на пластинах, т. е. из раствора уже отобрана почти вся серная кислота. Плотность от концентрации зависит пропорционально, и точно так же от плотности зависит заряд аккумулятора. На рис. ниже показана зависимость заряда аккумулятора от плотности электролита.
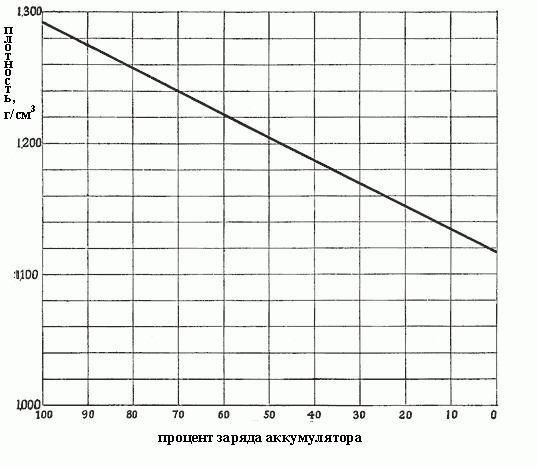
Изменение плотности электролита является лучшим средством определения состояния разряда аккумулятора, при условии, что он используется надлежащим образом.
Степени разряда автомобильного аккумулятора в зависимости от плотности электролита
Плотность его должна измеряться каждые две недели и постоянно должна вестись запись показаний для использования в будущем.
Чем плотнее электролит, тем больше кислоты он содержит, и тем более заряжен аккумулятор. Плотность в 1,300-1,280 г/см 3 указывает на полный заряд. Как правило, различаются следующие степени разряда аккумулятора в зависимости от плотности электролита:
- 1,300-1,280 – полностью заряжен:
- 1,280-1,200 – более чем наполовину разряжен;
- 1,200-1,150 – заряжен менее чем наполовину;
- 1,150 – практически разряжен.
У полностью заряженного аккумулятора перед подключением его автомобильной сети напряжение каждой ячейки составляет от 2,5 до 2,7 В. Как только подключается нагрузка, напряжение быстро падает примерно до 2,1 В в течение трех или четырех минут. Это происходит из-за формирования тонкого слоя сульфата свинца на поверхности отрицательных электродных пластин и между слоем перекиси свинца и металлом положительных пластин. Окончательное значение напряжения ячейки после подключения к автомобильной сети составляет около 2,15-2,18 вольт.
Когда ток начинает протекать через аккумулятор в течение первого часа работы, происходит падение напряжения до 2 В, объясняемое ростом внутреннего сопротивления ячеек из-за формирования большего количества сульфата, который заполняет поры пластин, и отбора кислоты из электролита. Незадолго до начала протекания тока плотность электролита максимальна и равна 1,300 г/см 3 . Поначалу его разрежение происходит быстро, но затем устанавливается сбалансированное состояние между плотностью кислоты вблизи пластин и в основном объеме электролита, отбор кислоты электродами поддерживается поступлением новых частей кислоты от основной части электролита. При этом средняя плотность электролита продолжает неуклонно уменьшаться по зависимости, показанной на рис. выше. После первоначального падения напряжение уменьшается более медленно, скорость его снижения зависит от нагрузки аккумулятора. Временной график процесса разряда показан на рис. ниже.
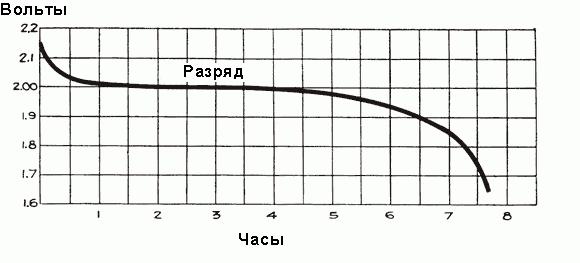
Контроль состояния электролита в аккумуляторе
Для определения плотности используется ареометр. Он состоит из небольшой запаянной стеклянной трубки с расширением на нижнем конце, заполненным дробью или ртутью, и градуированной шкалой на верхнем конце. Эта шкала помечена от 1,100 до 1,300 с различными промежуточными значениями, как показано на рис. ниже. Если этот ареометр помещается в электролит, то он будет опускаться до определенной глубины. При этом он будет вытеснять определенный объем электролита, и когда будет достигнуто равновесное положение, вес вытесненного объема просто будет равен весу ареометра. Поскольку плотность электролита равна отношению его веса к объему, а вес ареометра известен, то каждый уровень его погружения в раствор соответствует определенной его плотности.
Кислотные аккумуляторы; чтобы больше не было отвратительно читать то что люди о них пишут
Случайно узрел статью с комментариями к ней, и так злость во мне закипела по поводу безграмотности людей в области кислотных (свинцовых в простонародье) аккумуляторов, что не выдержал и решил написать «гикам» (чтобы быть гиком, как оказывается, мало купить дорогой телефон) краткую статью об аккумуляторах. С рассмотрением тех ошибок, которые мне постоянно мусолят глаза и вызывают праведное желание их исправить.Начнем с названия. Я очень часто вижу что тремя буквами А-К-Б называют все что можно зарядить, абсолютно любой аккумулятор. Особенно тремя буквами люди любят называть аккумуляторы типа Li-ion. На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
Далее перейдем к некоторым мифам, а именно главный миф — АКБ для автомобиля имеет некие существенные отличия от АКБ для ИБП. И вот нельзя их применять и там и там.
С химической точки зрения любые АКБ абсолютно одинаковы. Как-же они устроены? Очень кратко — если аккумулятор заряжен, то один электрод представляет собой свинцовую решетку с нанесенной на нее пастой из PbO2, второй -такую-же решетку с пастой губчатого свинца. Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец. Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Таких ячеек в 12В аккумуляторе 6 шт, в 6В — 3 шт. и т.д. Многих вводит в заблуждение значение напряжения на аккумуляторах. Причем значений напряжения номинального, заряда, разряда. С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
Например:
Тут мы видим, что в форсированном режиме напряжение заряда может быть аж 15В.
Все разъяснит кривая напряжения на АКБ:

Слева мы видим напряжение для аккумулятора из 12 ячеек (24В номинальных), 6 (12В номинальных) и, самое полезное, для одной ячейки. Там-же отмечены области нежелательных напряжений при разряде/ заряде. Из кривой можно сделать выводы:
1 Напряжение 12В, 24В и т.д. являются номинальными и показывают лишь число гальванических ячеек (путем деления на два) в батарее. Это просто название для удобства.
2 Напряжение при заряде могут достигать 2.5 В/ ячейку что для 12В аккумулятора соответствует 15В.
3 Напряжение заряженной батареи считается допустимым при значении 2.1-2.2 В/ячейку, что для 12В аккумулятора соответствует 12.6-13.2В.
Теоретически, батарею можно зарядить и до значений 2.4 В/ячейку или даже немного выше, однако, такая зарядка будет негативно сказываться как на состоянии электродов, так и на концентрации электролита. Однажды, перед сдачей в утиль, я легко зарядил 12В батарею до напряжения ок. 14.5В (уже не помню точное значение).
Итак, автор статьи с которой я начал, решил, что напряжение заряда автомобильной АКБ и АКБ от ИБП отличаются. Это неверно, у них одинаковый тип электродов и одинаковая концентрация серной кислоты в электролите (подобранная давным-давно экспериментальным путем, чтобы предоставлять максимальное напряжение и минимальном саморазряде). Однако, что-же происходит в батарее, почему ее нельзя заряжать при слишком высоком значении напряжения?
Почему в автомобильную АКБ нужно подливать воду, а в АКБ от ИБП не нужно? Эти вопросы позволяют нам плавно перейти в область напряжения разложения воды. Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
2H2O = 2H2 + O2
Теоретический расчет дает значение напряжения для этой реакции ок. 1.2В. Напоминаю, что напряжение на ячейке при заряде заведомо более 2В. К счастью, активно вода начинает разлагаться только выше 2В, а в промышленности для получения водорода и кислорода из нее процесс ведут и вовсе при 2.1-2.6В (при повышенной температуре). Как бы то ни было, тут мы приходим к выводу, что в конце процесса заряда АКБ будет неизбежно происходить процесс разложения воды в электролите на элементы. Образующиеся кислород и водород попросту улетучиваются из сферы реакции. Про них бытуют следующие мифы:
1. Водород крайне взрывоопасен! Перезарядишь аккумулятор и как минимум лишишься комнаты где тот был!
На самом деле, водорода в процессе электролиза выделяется ничтожно мало по сравнению с объемом комнаты. Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Очень редко случаются взрывы непосредственно в корпусах крупногабаритных АКБ из-за того, что выделяющийся водород по какой-то причине не может покинуть замкнутого пространства. Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
2. При электролизе может образоваться смертельно ядовитый и, не менее взрывоопасный чем водород, сероводород!
Не наш, периодически попадался миф в англоязычных постах. Теоретически конечно возможно подать такое большое напряжение и создать т.о. такую большую силу тока, что на катоде начнется процесс восстановления сульфат-иона. Напряжение для этого будет достаточным, а продукты восстановления не будут успевать диффундировать подальше от электрода и восстановление будет идти дальше. Но зарядка в пределах десятка-трех вольт и с ограничением силы тока в 6А на такое едва ли способна. Однажды, я наблюдал процесс восстановления сульфата до SO2, да, это возможно; однокурсницы по ошибке что-то сделали не то во время опыта. Но это большая редкость т.к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не H2S.
3. При электролизе мышьяк и сурьма из материала решеток будут восстанавливаться до ядовитых арсина и стибина!
Действительно, решетки содержат относительно много сурьмы, мышьяка в современных решетках, вероятно, нет вообще. При работе АКБ та решетка на которой происходит восстановление, т.е. катод, разрушению не может подвергаться. Выделяйся даже каким-то образом стибин, он бы тут-же взаимодействовал с PbSO4, восстанавливая его до металла.
Однако, некоторая практическая неприятность тут есть. Газообразные водород и кислород могут увлекать за собой капельки электролита, создавая аэрозоль серной кислоты. Аэрозоль серной кислоты, даже концентрированной, для человека не опасен и просто вызывает кашель. Однако, серная кислота — кошмар для тканей и бумаги. Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Так что газовыделения опасаться не стоит с бытовой точки зрения или стоит, но нужно ориентироваться именно на аэрозоль серной кислоты.
Итак, вода начала разлагаться на водород кислород, ее в электролите становится все меньше, что-же дальше? Если это АКБ в котором электролит просто налит в виде слоя жидкости, то начнется повышение саморазряда из-за повышения концентрации серной кислоты. Занятно, что это будет сопровождаться небольшим повышением напряжения (концентрация кислоты растет) на ячейке. Именно поэтому автовладельцы должны постоянно контролировать концентрацию серной кислоты в своих АКБ (при помощи ареометра) и доливать туда воду. Процедура доливания воды — необходимая часть процесса обслуживания любой АКБ. Кроме одного их типа, и мы сейчас об этом поговорим.
Иметь аккумулятор в котором болтается слой едкой, по отношению к металлам, жидкости конечно-же неудобно, а потому попытки избавиться непосредственно от жидкости предпринимались давно, начались чуть ли не в первой половине 20-го века. К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство. Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
Второй распространенный тип интереснее, это т.н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
Na2SiO3 + H2SO4 = Na2SO4 + SiO2 + H2O
Если исходный раствор силиката не отличается качеством, то кремневая кислота будет выделяться в виде стекловидной массы, но если он достаточно чист, то кремневая кислота осадится в виде красивого куска однородного полупрозрачного геля. На этом и основан способ получения гелевых АКБ — простое добавление силикатов к электролиту вызывает его затвердение в гелеобразную массу. Соответственно, вытекать оттуда уже нечему и АКБ действительно можно эксплуатировать в любом положении. Сам по себе процесс образования геля не повышает емкости АКБ и не улучшает его качеств, однако, производители его используют при производстве наиболее качественных моделей, а потому эти АКБ отличаются высоким качеством и большей емкостью. Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Оба типа АКБ объединяются в славный тип VRLA — valve-regulated lead-acid battery который и применяется в ИБП. Формально они считаются необслуживаемыми и терпящими эксплуатацию в любом положении, но это не совсем так. Более того, многие уже встречались с эффектом, когда буквально несколько мл воды возвращают к жизни, казалось бы, дохлую АКБ от ИБП. Так получается, потому что и эти аккумуляторы не капли не застрахованы от электролиза воды в электролите, а следовательно, и пересыхания. Все происходит точно так-же, как в крупногабаритных АКБ. А вот самые дорогие и крутые необслуживаемые АКБ содержат катализатор для рекомбинации выделяющихся газов обратно в воду и вот уже у них корпус действительно выполнен абсолютно герметичным. Обращаю внимание, что по-настоящему герметичным и необслуживаемым может быть и аккумулятор типа AGM и GEL, но они-же могут ими и не быть и не содержать катализатора рекомбинации кислорода и водорода. Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Хотелось бы добавить несколько слов о режимах разряда. Производители АКБ указывают какой ток максимально допустим для той или иной модели, но нужно понимать, что аккумулятор — просто смесь химических веществ и ЭДС генерируется исключительно химическим путем. Это не конденсатор который, по электрогидравлической аналогии, можно сравнить с неким механическим сосудом (с гибкой мембраной). Хотя АКБ могут выдавать очень большие значения силы тока, в реальности они лучше всего эксплуатируются как раз при небольших токах, что в разряде, что в заряде. Поэтому ИБП, рассчитанные на заряды небольших АКБ, при работе с крупногабаритными будут заряжать их в наиболее щадящем режиме. Впрочем, в течении далеко не одних суток. Интересно обратить внимание на то, что чем выше мощность ИБП, тем больше аккумуляторов последовательно предпочитает собирать производитель. Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Подводя итоги:
1. Малогабаритные и крупногабаритные АКБ идентичны по устройству.
2. Для подавляющего большинства АКБ любого размера доливание воды является необходимой частью текущего обслуживания.
3. Лишь немногие из дорогих моделей АКБ содержат механизм рекомбинации газов и могут быть названы действительно необслуживаемыми.
4. Сам по себе водород, который выделяется при заряде (а это равно постоянной работе в ИБП) АКБ, не является существенной угрозой или проблемой.
5. Нужно очень внимательно работать с АКБ, тщательно избегая пролива даже малейших капель электролита, или лишитесь одежды.
6. Разряд и заряд малыми токами являются наиболее предпочтительными режимами эксплуатации АКБ.
§42. Кислотные аккумуляторы
Принцип действия. Аккумулятором называется химический источник тока, который способен накапливать (аккумулировать) в себе электрическую энергию и по мере необходимости отдавать ее во внешнюю цепь. Накапливание в аккумуляторе электрической энергии происходит при пропускании по нему тока от
Рис. 158. Заряд (а) и разряд (б) аккумулятора
постороннего источника (рис. 158,а). Этот процесс, называемый зарядом аккумулятора, сопровождается превращением электрической энергии в химическую, в результате чего аккумулятор сам становится источником тока. При разряде аккумулятора (рис. 158, б) происходит обратное превращение химической энергии в электрическую. Аккумулятор обладает большим преимуществом по сравнению с гальваническим элементом. Если элемент разрядился, то он приходит в полную негодность; аккумулятор же. после разряда может быть вновь заряжен и будет служить источником электрической энергии. В зависимости от рода электролита аккумуляторы разделяют на кислотные и щелочные.

На локомотивах и электропоездах наибольшее распространение получили щелочные аккумуляторы, которые имеют значительно больший срок службы, чем кислотные. Кислотные аккумуляторы ТН-450 применяют только на тепловозах, они имеют емкость 450 А*ч, номинальное напряжение — 2,2 В. Аккумуляторная батарея 32 ТН-450 состоит из 32 последовательно соединенных аккумуляторов; буква Т означает, что батарея установлена на тепловозе, буква Н — тип положительных пластин (намазные).
Устройство. В кислотном аккумуляторе электродами являются свинцовые пластины, покрытые так называемыми активными массами, которые взаимодействуют с электролитом при электрохимических реакциях в процессе заряда и разряда. Активной массой положительного электрода (анода) служит перекись свинца PbO2, а активной массой отрицательного электрода (катода) — чистый (губчатый) свинец Pb. Электролитом является 25—34 %-ный водный раствор серной кислоты.
Пластины аккумулятора могут иметь конструкцию поверхностного или намазного типа. Пластины поверхностного типа отливают из свинца; поверхность их, на которой происходят электрохимические реакции, увеличена благодаря наличию ребер, борозд и т. п. Их применяют в стационарных аккумуляторных батареях и некоторых батареях пассажирских вагонов.
В аккумуляторных батареях тепловозов применяют пластины намазного типа (рис. 159, а). Такие пластины имеют остов из сплава свинца с сурьмой, в котором устроен ряд ячеек, заполняемых пастой.
Ячейки пластин после заполнения пастой закрывают свинцовыми листами с большим количеством отверстий. Эти листы предотвращают возможность выпадания из пластин активной массы и не препятствуют в то же время доступу к ней электролита.
Исходным материалом для изготовления пасты для положительных пластин служит порошок свинца Pb, а для отрицательных— порошок , перекиси свинца PbO2, которые замешиваются на водном растворе серной кислоты. Строение активных масс в таких пластинах пористое; благодаря этому в электрохимических реакциях участвуют не только поверхностные, но и глубоколежащие слои электродов аккумулятора.
Для повышения пористости и уменьшения усадки активной массы в пасту добавляют графит, сажу, кремний, стеклянный порошок, сернокислый барий и другие инертные материалы, называемые расширителями. Они не принимают участия в электрохимических реакциях, но затрудняют слипание (спекание) частиц свинца и его окислов и предотвращают этим уменьшение пористости.
Намазные пластины имеют большую поверхность соприкосновения с электролитом и хорошо им пропитываются, что способствует уменьшению массы и размеров аккумулятора и позволяет получать при разряде большие токи.
Рис. 159. Устройство пластин (а) и общий вид (б) кислотного аккумулятора: 1 — блок намазных отрицательных пластин; 2 — выводные штыри; 3 — блок панцирных положительных пластин; 4 — панцирь; 5 — активная масса; 6 — отверстие с пробкой для заливки электролита; 7 — крышка; 8 — эбонитовый сосуд; 9 — пространство для осаждения шлама
При изготовлении аккумуляторов пластины подвергают специальным зарядно-разрядным циклам. Этот процесс носит название формовки аккумулятора. В результате формовки паста положительных пластин электрохимическим путем превращается в перекись (двуокись) свинца PbO2 и приобретает коричневый цвет. Паста отрицательных пластин при формовке переходит в чистый свинец Pb, имеющий пористую структуру и называемый поэтому губчатым; отрицательные пластины приобретают серый цвет.
В некоторых аккумуляторах применены положительные пластины панцирного типа. В них каждая положительная пластина заключена в специальный панцирь (чехол) из эбонита или стеклоткани. Панцирь надежно удерживает активную массу пластины от осыпания при тряске и толчках; для сообщения же активной массы пластин с электролитом в панцире делают горизонтальные прорези шириной около 0725 мм.
Для предотвращения замыкания пластин посторонними предметами (щупом для измерения уровня электролита, устройством для заливки электролита и др.) пластины в некоторых аккумуляторах покрывают полихлорвиниловой сеткой.
Для увеличения емкости в каждый аккумулятор устанавливают несколько положительных и отрицательных пластин; одноименные пластины соединяют параллельно в общие блоки, к которым приваривают выводные штыри. Блоки положительных и отрицательных пластин обычно устанавливают в эбонитовом аккумуляторном сосуде (рис. 159,б) так, чтобы между каждыми двумя
Рис. 160. Прохождение через электролит положительных и отрицательных ионов при разряде (а) и заряде (б) кислотного аккумулятора
пластинами одной полярности располагались пластины другой полярности. По краям аккумулятора ставят отрицательные пластины, так как положительные пластины при установке по краям склонны к короблению. Пластины отделяют одну от другой сепараторами, выполненными из микропористого эбонита, полихлорвинила, стекловойлока или другого изоляционного материала. Сепараторы предотвращают возможность короткого замыкания между пластинами при их короблении.
Пластины устанавливают в аккумуляторном сосуде так, чтобы между их нижней частью и дном сосуда имелось некоторое свободное пространство. В этом пространстве скапливается свинцовый осадок (шлам), образующийся вследствие отпадания отработавшей активной массы пластин в процессе эксплуатации.
Разряд и заряд. При разряде аккумулятора (рис. 160, а) положительные ионы H2+ и отрицательные ионы кислотного остатка
S04-, на которые распадаются молекулы серной кислоты H2S04 электролита 3, направляются соответственно к положительному
1 и отрицательному 2 электродам и вступают в электрохимические реакции с их активными массами. Между электродами возникает
разность потенциалов около 2 В, обеспечивающая прохождение электрического тока при замыкании внешней цепи. В результате
электрохимических реакций, возникающих при взаимодействии ионов водорода с перекисью свинца PbO2 положительного
электрода и ионов сернокислого остатка S04— со свинцом Pb отрицательного электрода, образуется сернокислый свинец PbS04 (сульфат свинца), в который превращаются поверхностные слои активной массы обоих электродов. Одновременно при этих реакциях образуется некоторое количество воды, поэтому концентрация серной кислоты понижается, т. е. плотность электролита уменьшается.
Аккумулятор может разряжаться теоретически до полного превращения активных масс электродов в сернокислый свинец и истощения электролита. Однако практически разряд прекращают гораздо раньше. Образующийся при разряде сернокислый свинец представляет собой соль белого цвета, плохо растворяющуюся в электролите и обладающую низкой электропроводностью. Поэтому разряд ведут не до конца, а только до того момента, когда в сернокислый свинец перейдет около 35 % активной массы. В этом случае образовавшийся сернокислый свинец равномерно распределяется в виде мельчайших кристалликов в оставшейся активной массе, которая сохраняет еще достаточную электропроводность, чтобы обеспечить напряжение между электродами 1,7—1,8 В.
Разряженный аккумулятор подвергают заряду, т. е. присоединяют к источнику тока с напряжением, большим напряжения аккумулятора. При заряде (рис. 160,б) положительные ионы водорода перемещаются к отрицательному электроду 2, а отрицательные ионы сернокислого остатка S04— — положительному электроду 1 и вступают в химическое взаимодействие с сульфатом свинца PbS04, покрывающим оба электрода. В процессе возникающих электрохимических реакций сульфат свинца PbS04 растворяется и на электродах вновь образуются активные массы: перекись свинца PbO2 на положительном электроде и губчатый свинец Pb — на отрицательном. Концентрация серной кислоты при этом возрастает, т. е. плотность электролита увеличивается.
Электрохимические реакции при разряде и заряде аккумулятора могут быть выражены уравнением
PbO2 + Pb + 2H2SO4 ? 2PbSO4 + 2H2O
Читая это уравнение слева направо, получаем процесс разряда, справа налево — процесс заряда.
Номинальный разрядный ток численно равен 0,1СНОМ, максимальный при запуске дизеля (стартерный режим) — примерно 3СНОМ, зарядный ток — 0,2 СНОМ, где СНОМ — номинальная емкость.
Полностью заряженный аккумулятор имеет э. д. с. около 2,2 В. Таково же приблизительно и напряжение на его зажимах, так как внутреннее сопротивление аккумулятора весьма мало. При разряде напряжение аккумулятора довольно быстро падает до 2 В, а затем медленно понижается до 1,8—1,7 В (рис. 161), при этом напряжении разряд прекращают во избежание повреждения аккумулятора. Если разряженный аккумулятор оставить на некоторое время в бездействии, то напряжение его снова восстанавливается до среднего значения 2 В. Это явление носит название «отдыха» аккумулятора. При нагрузке подобного «отдохнувшего» аккумулятора напряжение быстро понижается, поэтому измерение напряжения аккумулятора без нагрузки не дает правильного суждения о степени разряда.
При заряде напряжение аккумулятора быстро поднимается до 2,2 В, а затем медленно повышается до 2,3 В и, наконец, снова довольно быстро возрастает до 2,6—2,7 В. При 2,4 В начинают выделяться пузырьки газа, образующегося в результате разложения воды на водород и кислород. При 2,5 В оба электрода выделяют сильную струю газа, а при 2,6—2,7 В аккумулятор начинает как бы кипеть, что служит признаком окончания заряда. При отключении аккумулятора от источника зарядного тока напряжение его быстро снижается до 2,2 В.
Уход за аккумуляторами. Кислотные аккумуляторы быстро теряют емкость или даже приходят в полную негодность при
Рис. 161. Кривые напряжения кислотного аккумулятора при заряде и разряде
неправильной эксплуатации. В них происходит саморазряд, в результате которого они теряют свою емкость (примерно 0,5— 0,7 % в сутки). Для компенсации саморазряда неработающие аккумуляторные батареи необходимо периодически подзаряжать. При загрязнении электролита, а также крышек аккумуляторов, их выводов и междуэлементных соединений происходит повышенный саморазряд, быстро истощающий батарею.
Батарея аккумулятора должна быть всегда чистой, а выводы для предохранения от окисления покрыты тонким слоем технического вазелина. Периодически нужно проверять уровень электролита и степень заряженности аккумуляторов. Аккумуляторы должны периодически заряжаться. Хранение незаряженных аккумуляторов недопустимо. При неправильной эксплуатации аккумуляторов (разряде ниже 1,8—1,7 В, систематическом недозаряде, неправильном проведении заряда, длительном хранении незаряженного аккумулятора, понижении уровня электролита, чрезмерной плотности электролита) происходит повреждение их пластин, называемое сульфатацией. Это явление заключается в переходе мелкокристаллического сульфата свинца, покрывающего пластины при разряде, в нерастворимые крупнокристаллические химические соединения, которые при заряде не переходят в перекись свинца РbO2 и свинец РЬ. При этом аккумулятор становится непригодным для эксплуатации.

Серная кислота аккумуляторная
Описание:Серная кислота — бесцветная маслянистая жидкость, не имеющая запаха. С водой и серным ангидридом смешивается в любых соотношениях с выделением большого количества тепла. Контактная серная кислота с массовой долей моногидрата 92,5-94,0% является водным раствором моногидрата (100% серной кислоты). В технике под серной кислотой подразумевают любые соединения H2SO4 с водой. Водные растворы серной кислоты характеризуются массовой долей в них H2SO4 или SO3
Серная кислота — одна из самых активных неорганических кислот. Она реагирует почти со всеми металлами и их оксидами, вступает в реакции обмена, обладает окислительными и другими важными свойствами. Основные физико-химические свойства растворов серной кислоты зависят от соотношения в ней воды и серного ангидрида (триоксида серы).
Применение:Серная кислота используется в производстве минеральных удобрений, красителей, химических волокон, а также в металлургии. Она применяется для различных технологических целей в текстильной, пищевой и др. отраслях промышленности. Аккумуляторная серная кислота применяется после разбавления ее дистиллированной водой в качестве электролита для заливки свинцовых аккумуляторов.
В качестве электролита для аккумуляторных батарей применяют раствор серной аккумуляторной кислоты в дистиллированной воде. Для различных климатических и температурных условий, в которых батарее предстоит работать, используют электролит различной плотности. Плотность электролита зависит от концентрации раствора серной аккумуляторной кислоты — чем больше концентрация раствора, тем больше плотность электролита и от температуры раствора — чем выше температура, тем ниже плотность. Концентрация или плотность электролита является точным критерием степени разряженности аккумулятора. В качестве точки отсчета, для определения текущей степени разряженности аккумулятора, принимается нормативная плотность электролита, т.е. плотность, приобретенная после первого полого заряда. Для свинцовых аккумуляторов характерно сильное разбавление электролита во время разряда из-за участия в реакции серной аккумуляторной кислоты с образованием воды. В заряженных аккумуляторах концентрация кислоты равна 30…40%. Чем меньше объем электролита, в сравнении с массой электродов, тем быстрее снижается концентрация кислоты при разряде. В конце разряда она составляет от 10 до 25%.
Серная кислота
ГОСТ 667-73
Влияние суперпластификатора и ускорителя набора прочности ПФМ-НЛК на подвижность бетонной смеси и прочностные характеристики бетона
| Технические характеристики | Высший сорт | Первый сорт |
|---|---|---|
| Массовая доля моногидрата (H2SO4), % | 92-94 | 92-94 |
| Массовая доля железа (Fe), % | 0,005 | 0,01 |
| Массовая доля остатка после прокаливания, %, не более | 0,02 | 0,03 |
| Массовая доля оксидов азота (N2O4), %, не более | 0,00003 | 0,00001 |
| Массовая доля мышьяка (As), %, не более | 0,00005 | 0,00008 |
| Массовая доля хлористых соединений (Cl), %, не более | 0,0002 | 0,0003 |
| Массовая доля марганца (Mn), %, не более | 0,00005 | 0,0001 |
| Массовая доля суммы тяжелых металлов в пересчете на свинец (Pb), %, не более | 0,01 | 0,01 |
| Массовая доля меди (Cu), %, не более | 0,0005 | 0,0005 |
| Массовая доля веществ, восстанавливающих KMnO4, см3 раствора с (1/5 KMnO4) = 0,01 моль/дм3, не более | 4,5 | 7 |
| Прозрачность | Должна выдерживать испытание по п. 3.13 | |
Серная кислота упаковывается в ж/д и авто цистерны, канистры, кубовые емкости.
Хранение:Техническая серная кислота и олеум (концентрированная серная кислота) должны храниться в емкостях из стали или спецстали, как нефутерованных, так и футерованных кислотоупорным кирпичом или кислотоустойчивым материалом.
Транспортировка:
Серную кислоту техническую транспортируют в железнодорожных сернокислотных цистернах в соответствии с правилами перевозок грузов. На цистерны должны быть нанесены специальные трафареты в соответствии с правилами перевозок грузов, действующими на ж.д. транспорте.
Кислота серная пожаро- и взрывобезопасна, при соприкосновении ее с водой происходит бурная реакция с большим выделением тепла, паров и газов. Токсична. По степени воздействия на организм относится к веществам 2-го класса опасности. При работе с серной кислотой обязательно применять спецодежду.
чтобы больше не было отвратительно читать то, что люди о них пишут
Случайно узрел статью с комментариями к ней, и так злость во мне закипела по поводу безграмотности людей в области кислотных (свинцовых в простонародье) аккумуляторов, что не выдержал и решил написать «гикам» (чтобы быть гиком, как оказывается, мало купить дорогой телефон) краткую статью об аккумуляторах. С рассмотрением тех ошибок, которые мне постоянно мусолят глаза и вызывают праведное желание их исправить.
Начнем с названия. Я очень часто вижу что тремя буквами А-К-Б называют все что можно зарядить, абсолютно любой аккумулятор. Особенно тремя буквами люди любят называть аккумуляторы типа Li-ion. На самом-же деле АКБ аббревиатура от Аккумуляторная Кислотная Батарея. Под ними подразумевается лишь один тип аккумулятора — свинцовый кислотный. С современной точки зрения это название вызывает некоторый когнитивный диссонанс т.к. на данный момент значение слова «батарейка» т.е. гальванического элемента который зарядить нельзя перешло на слово «батарея». И получается как будто бы из-за слова «аккумуляторная» это аккумулятор который зарядить можно, а из-за слова «батарея» это как будто батарейка которую зарядить нельзя. В реальности-же батарея — просто цепь гальванических элементов и со словом «батарейка» имеет общий лишь корень.
Далее перейдем к некоторым мифам, а именно главный миф — АКБ для автомобиля имеет некие существенные отличия от АКБ для ИБП. И вот нельзя их применять и там и там.
С химической точки зрения любые АКБ абсолютно одинаковы. Как-же они устроены? Очень кратко — если аккумулятор заряжен, то один электрод представляет собой свинцовую решетку с нанесенной на нее пастой из PbO2, второй -такую-же решетку с пастой губчатого свинца. Электролитом служит раствор серной кислоты. В процессе разряда PbO2 восстанавливается и взаимодействуя с серной кислотой образует PbSO4. Свинец на другом электроде окисляется и опять-же образует PbSO4. В конце разрядки мы имеем обе решетчатые пластины заполненные (более или менее) сульфатом свинца. При зарядке аккумулятора происходит электролиз и из сульфата свинца вновь образуется диоксид и металлический свинец.
Конечно-же, тут нужно подчеркнуть, что электроды при этом не равны и путать их полярность не стоит т.к. еще на стадии производства в намазку электродов вводятся соответствующие добавки, улучшающие их эксплуатационные свойства. При этом добавки полезные для одного электрода вредны для другого. В очень старые времена, где-то в начале прошлого века, в условиях простых аккумуляторов, вероятно, была допустима переполюсовка аккумулятора по ошибке или с какими-то целями и он какое-то время после этого работал. В том что она допустима сейчас я сомневаюсь.
Таких ячеек в 12В аккумуляторе 6 шт, в 6В — 3 шт. и т.д. Многих вводит в заблуждение значение напряжения на аккумуляторах. Причем значений напряжения номинального, заряда, разряда. С одной стороны, аккумуляторы называются 12В (и 6В, 24В тоже есть, по-моему, даже 4В изредка встречаются) но на корпусе тех-же аккумуляторов для ИБП производитель указывает напряжение выше 13.5В.
Например:

Тут мы видим, что в форсированном режиме напряжение заряда может быть аж 15В.
Все разъяснит кривая напряжения на АКБ:

Слева мы видим напряжение для аккумулятора из 12 ячеек (24В номинальных), 6 (12В номинальных) и, самое полезное, для одной ячейки. Там-же отмечены области нежелательных напряжений при разряде/ заряде. Из кривой можно сделать выводы:
- Напряжение 12В, 24В и т.д. являются номинальными и показывают лишь число гальванических ячеек (путем деления на два) в батарее. Это просто название для удобства.
- Напряжение при заряде могут достигать 2.5 В/ ячейку что для 12В аккумулятора соответствует 15В.
- Напряжение заряженной батареи считается допустимым при значении 2.1-2.2 В/ячейку, что для 12В аккумулятора соответствует 12.6-13.2В.
Теоретически, батарею можно зарядить и до значений 2.4 В/ячейку или даже немного выше, однако, такая зарядка будет негативно сказываться как на состоянии электродов, так и на концентрации электролита. Однажды, перед сдачей в утиль, я легко зарядил 12В батарею до напряжения ок. 14.5В (уже не помню точное значение).
Итак, автор статьи с которой я начал, решил, что напряжение заряда автомобильной АКБ и АКБ от ИБП отличаются. Это неверно, у них одинаковый тип электродов и одинаковая концентрация серной кислоты в электролите (подобранная давным-давно экспериментальным путем, чтобы предоставлять максимальное напряжение и минимальном саморазряде). Однако, что-же происходит в батарее, почему ее нельзя заряжать при слишком высоком значении напряжения?
Почему в автомобильную АКБ нужно подливать воду, а в АКБ от ИБП не нужно? Эти вопросы позволяют нам плавно перейти в область напряжения разложения воды. Как я написал выше, при зарядке аккумулятора происходит электролиз. Однако, не весь ток расходуется на превращение PbSO4 в PbO2 и Pb. Часть тока будет неизбежно расходоваться и на разложение воды, составляющей значительную часть электролита:
2h3O = 2h3 + O2
Теоретический расчет дает значение напряжения для этой реакции ок. 1.2В. Напоминаю, что напряжение на ячейке при заряде заведомо более 2В. К счастью, активно вода начинает разлагаться только выше 2В, а в промышленности для получения водорода и кислорода из нее процесс ведут и вовсе при 2.1-2.6В (при повышенной температуре). Как бы то ни было, тут мы приходим к выводу, что в конце процесса заряда АКБ будет неизбежно происходить процесс разложения воды в электролите на элементы. Образующиеся кислород и водород попросту улетучиваются из сферы реакции.
Про них бытуют следующие мифы:
1. Водород крайне взрывоопасен! Перезарядишь аккумулятор — и как минимум лишишься комнаты, где тот был!
На самом деле, водорода в процессе электролиза выделяется ничтожно мало по сравнению с объемом комнаты. Водород взрывается при концентрации от 4% в воздухе. Если мы допустим, что электролиз ведется в комнате размером 3*3*3 метра или 27 метров куб., то нам понадобится наполнить помещение 27*0.04=1.1 метров куб. водорода. Для получения такого количества h3 нужно было бы полностью разложить ок. 49 моль воды или 884 грамма ее. Если кто-то наблюдал электролиз, то поймет насколько это много. Или попробуем перейти ко времени. При силе тока в стандартной зарядке для крупногабаритных АКБ в 6А, уравнение Фарадея дает время, необходимое для получения этого количества водорода, аж 437 часов или 18.2 дня. Чтобы наполнить комнату водородом до взрывоопасной концентрации нужно забыть про зарядку на 2 с половиной недели! Но даже если это случится, концентрация серной кислоты просто будет расти пока ее раствор не приобретет слишком высокое сопротивление для жалких 12В зарядки и сила тока не станет ничтожной. Да и водород попросту улетучится.
Очень редко случаются взрывы непосредственно в корпусах крупногабаритных АКБ из-за того, что выделяющийся водород по какой-то причине не может покинуть замкнутого пространства. Но и в этом случае нечего страшного не бывает — чаще всего взрыва хватает только на небольшую деформацию верхней части корпуса, но не на разрыв свинцовых соединений. И АКБ еще может работать дальше даже после таких повреждений.
2. При электролизе может образоваться смертельно ядовитый и, не менее взрывоопасный чем водород, сероводород!
Не наш, периодически попадался миф в англоязычных постах. Теоретически конечно возможно подать такое большое напряжение и создать т.о. такую большую силу тока, что на катоде начнется процесс восстановления сульфат-иона. Напряжение для этого будет достаточным, а продукты восстановления не будут успевать диффундировать подальше от электрода и восстановление будет идти дальше. Но зарядка в пределах десятка-трех вольт и с ограничением силы тока в 6А на такое едва ли способна. Однажды, я наблюдал процесс восстановления сульфата до SO2, да, это возможно; однокурсницы по ошибке что-то сделали не то во время опыта. Но это большая редкость т.к. там концентрация серной кислоты была заметно выше той, что используется в АКБ, была иная конструкция электрода и иной его материал и, естественно, напряжения и сила тока были были непомерными. И SO2 не h3S.
3. При электролизе мышьяк и сурьма из материала решеток будут восстанавливаться до ядовитых арсина и стибина!
Действительно, решетки содержат относительно много сурьмы, мышьяка в современных решетках, вероятно, нет вообще. При работе АКБ та решетка на которой происходит восстановление, т.е. катод, разрушению не может подвергаться. Выделяйся даже каким-то образом стибин, он бы тут-же взаимодействовал с PbSO4, восстанавливая его до металла.
Однако, некоторая практическая неприятность тут есть. Газообразные водород и кислород могут увлекать за собой капельки электролита, создавая аэрозоль серной кислоты. Аэрозоль серной кислоты, даже концентрированной, для человека не опасен и просто вызывает кашель. Однако, серная кислота — кошмар для тканей и бумаги. Стоит даже небольшому количеству серной кислоты попасть на одежду и там обязательно появятся дырки или ткань разорвется по этому месту. Через недели, если кислоты много, через месяц, но одежда истлеет.
Так что газовыделения опасаться не стоит с бытовой точки зрения или стоит, но нужно ориентироваться именно на аэрозоль серной кислоты.
Итак, вода начала разлагаться на водород кислород, ее в электролите становится все меньше, что-же дальше? Если это АКБ в котором электролит просто налит в виде слоя жидкости, то начнется повышение саморазряда из-за повышения концентрации серной кислоты. Занятно, что это будет сопровождаться небольшим повышением напряжения (концентрация кислоты растет) на ячейке. Именно поэтому автовладельцы должны постоянно контролировать концентрацию серной кислоты в своих АКБ (при помощи ареометра) и доливать туда воду.
Процедура доливания воды — необходимая часть процесса обслуживания любой АКБ!
Кроме одного их типа, и мы сейчас об этом поговорим.
Иметь аккумулятор, в котором болтается слой едкой, по отношению к металлам, жидкости конечно-же неудобно, а потому попытки избавиться непосредственно от жидкости предпринимались давно, начались чуть ли не в первой половине 20-го века. К слову сказать, не то чтобы слой серной кислоты прямо плескался вокруг электродов. В реальности она неплохо распределена между электродами и окружающими их сепараторами даже в дешевых моделях. Итак, первым вариантом было использование стекловолокна. Достаточно просто окружить электроды стекловолокном которое пропитано серной кислотой и большинство проблем решится. Этот тип АКБ носит название AGM (absorbent glass mat) и таких АКБ для ИБП подавляющее большинство.
Хотя такие АКБ малого форм-фактора и зачастую позиционируются как те, которые можно эксплуатировать в любом положении, с этим нельзя вполне согласиться. Вскрытие крышки стандартного дешевого AGM аккумулятора показывает, что никаких особых крышек там нет, а следовательно, электролит от вытекания удерживают лишь капиллярные силы. Я почти уверен, что если погонять AGM аккумулятор перевернутым вверх дном, то уже после одной зарядки из него польется серная кислота под давление газов.
Второй распространенный тип интереснее, это т.н. гелевые АКБ. А получаются они благодаря следующему. Если подкислять растворимые силикаты, то будет происходить выделение кремневой кислоты:
Na2SiO3 + h3SO4 = Na2SO4 + SiO2 + h3O
Если исходный раствор силиката не отличается качеством, то кремневая кислота будет выделяться в виде стекловидной массы, но если он достаточно чист, то кремневая кислота осадится в виде красивого куска однородного полупрозрачного геля. На этом и основан способ получения гелевых АКБ — простое добавление силикатов к электролиту вызывает его затвердение в гелеобразную массу. Соответственно, вытекать оттуда уже нечему и АКБ действительно можно эксплуатировать в любом положении. Сам по себе процесс образования геля не повышает емкости АКБ и не улучшает его качеств, однако, производители его используют при производстве наиболее качественных моделей, а потому эти АКБ отличаются высоким качеством и большей емкостью. Занятно, что в обоих случаях носителем электролита является SiO2 в той или иной форме.
Оба типа АКБ объединяются в славный тип VRLA — valve-regulated lead-acid battery который и применяется в ИБП. Формально они считаются необслуживаемыми и терпящими эксплуатацию в любом положении, но это не совсем так. Более того, многие уже встречались с эффектом, когда буквально несколько мл воды возвращают к жизни, казалось бы, дохлую АКБ от ИБП. Так получается, потому что и эти аккумуляторы не капли не застрахованы от электролиза воды в электролите, а следовательно, и пересыхания. Все происходит точно так-же, как в крупногабаритных АКБ. А вот самые дорогие и крутые необслуживаемые АКБ содержат катализатор для рекомбинации выделяющихся газов обратно в воду и вот уже у них корпус действительно выполнен абсолютно герметичным. Обращаю внимание, что по-настоящему герметичным и необслуживаемым может быть и аккумулятор типа AGM и GEL, но они-же могут ими и не быть и не содержать катализатора рекомбинации кислорода и водорода. Тогда, несмотря на казалось бы продвинутую конструкцию, пользователю придется либо чаще покупать новые аккумуляторы, либо доливать воду при помощи шприца.
Хотелось бы добавить несколько слов о режимах разряда. Производители АКБ указывают какой ток максимально допустим для той или иной модели, но нужно понимать, что аккумулятор — просто смесь химических веществ и ЭДС генерируется исключительно химическим путем. Это не конденсатор который, по электрогидравлической аналогии, можно сравнить с неким механическим сосудом (с гибкой мембраной). Хотя АКБ могут выдавать очень большие значения силы тока, в реальности они лучше всего эксплуатируются как раз при небольших токах, что в разряде, что в заряде. Поэтому ИБП, рассчитанные на заряды небольших АКБ, при работе с крупногабаритными будут заряжать их в наиболее щадящем режиме. Впрочем, в течении далеко не одних суток. Интересно обратить внимание на то, что чем выше мощность ИБП, тем больше аккумуляторов последовательно предпочитает собирать производитель. Тут все логично — большие токи разряда маленькие АКБ выдерживают очень плохо.
Подводя итоги:
- Малогабаритные и крупногабаритные АКБ идентичны по устройству.
- Для подавляющего большинства АКБ любого размера доливание воды является необходимой частью текущего обслуживания.
- Лишь немногие из дорогих моделей АКБ содержат механизм рекомбинации газов и могут быть названы действительно необслуживаемыми.
- Сам по себе водород, который выделяется при заряде (а это равно постоянной работе в ИБП) АКБ, не является существенной угрозой или проблемой.
- Нужно очень внимательно работать с АКБ, тщательно избегая пролива даже малейших капель электролита, или лишитесь одежды.
- Разряд и заряд малыми токами являются наиболее предпочтительными режимами эксплуатации АКБ.
Утащено с HABRа, автор — @JohnHenry89
Михаил 05 ноября 2018 Автомобиль: Лендровер фрил 2
Взрываются все же.
Мой знакомый во время зарядки подошел к аккумулятору с сигаретой. Взрывом его опалило так, что сгорела слизистая носа и он перестал чувствовать запахи и вкусы еды. Точнее аромат, который мы считаем вкусом. Например отличить картон от клубники без слизистой носа вы не сможете. Знакомый грузин и любит хорошую еду, для него это было очень неприятно. К счастью нос и восприятие вкуса восстановились где-то через месяц.
Аккумулятор цел, и помещение естественно тоже.
Дмитрий К.
Курить вообще вредно. Об этом все знают, но не всегда ожидают, что вот прям настолько вредно
Павел 20 июня 2018 Автомобиль: Nissan
Отличная статья, спасибо!
Администратор
Рады для вас стараться!
Написать сообщение
Виды и типы аккумуляторных батарей — подробно!
- Категория: Поддержка по аккумуляторным батареям
- Опубликовано 25.06.2015 19:00
- Автор: Abramova Olesya
Аккумуляторная батарея – это источник постоянного тока, который предназначен для накопления и хранения энергии. Подавляющее число типов аккумуляторных батарей основано на циклическом преобразовании химической энергии в электрическую, это позволяет многократно заряжать и разряжать батарею.
Еще в 1800 году Алессандро Вольта произвел поразительное открытие, когда опустил в банку, наполненную кислотой, две металлические пластины – медную и цинковую, после чего доказал, что по соединяющей их проволоке протекает электрический ток. Спустя более чем 200 лет, современные аккумуляторные батареи продолжают производить на основе открытия Вольта.
|
|
|
|
Рисунок 1. Вольтов столб из шести элементов. |
Рисунок 2. Алессандро Джузеппе Антонио Анастасио Вольта |
Со времени изобретения первого аккумулятора прошло не больше 140 лет и сейчас сложно представить современный мир без резервных источников питания на основе батарей. Аккумуляторы применяются всюду, начиная с самых безобидных бытовых устройств: пульты управления, переносные радиоприемники, фонари, ноутбуки, телефоны, и заканчивая системами безопасности финансовых учреждений, резервными источниками питания для центров хранения и передачи данных, космической отраслью, атомной энергетикой, связью и т. д.
Развивающийся мир нуждается в электрической энергии столь сильно, сколько человеку нужен кислород для жизни. Поэтому конструкторы и инженеры ежедневно ведут работу по оптимизации имеющихся типов аккумуляторов и периодически разрабатывают новые виды и подвиды.
Основные виды аккумуляторов приведены в таблице №1.
|
Тип |
Применение |
Обозначение |
Рабочая температура, ºC |
Напряжение элемента, В |
Удельная энергия, Вт∙ч/кг |
|
Литий-ионный (Литий-полимерный, литий-марганцевый, литий-железно-сульфидный, литий-железно-фосфатный, литий-железо-иттрий-фосфатный, литий-титанатный, литий-хлорный, литий-серный) |
Транспорт, телекоммуникации, системы солнечной энергии, автономное и резервное электроснабжение, Hi-Tech, мобильные источники питания, электроинструмент, электромобили и т.д. |
Li-Ion (Li-Co, Li-pol, Li-Mn, LiFeP, LFP, Li-Ti, Li-Cl, Li-S) |
-20 … +40 |
3,2-4,2 |
280 |
|
никель-солевой |
Автомобильный транспорт, Ж\Д транспорт, Телекоммуникации, Энергетика, в том числе альтернативная, Системы накопления энергии |
Na/NiCl |
-50 … +70 |
2,58 |
140 |
|
никель-кадмиевый |
Электрокары, речные и морские суда, авиация |
Ni-Cd |
–50 … +40 |
1,2-1,35 |
40 – 80 |
|
железо-никелевый |
Резервное электропитание, тяговые для электротранспорта, цепи управления |
Ni-Fe |
–40 … +46 |
1,2 |
100 |
|
никель-водородный |
Космос |
Ni-h3 |
|
1,5 |
75 |
|
никель-металл-гидридный |
электромобили, дефибрилляторы, ракетно-космическая техника, системы автономного энергоснабжения, радиоаппаратура, осветительная техника. |
Ni-MH |
–60 … +55 |
1,2-1,25 |
60 – 72 |
|
никель-цинковый |
Фотоаппараты |
Ni-Zn |
–30 … +40 |
1,65 |
60 |
|
свинцово-кислотный |
Системы резервного питания, бытовая техника, ИБП, альтернативные источники питания, транспорт, промышленность и т.д. |
Pb |
–40 … +40 |
2, 11-2,17 |
30 – 60 |
|
серебряно-цинковый |
Военная сфера |
Ag-Zn |
–40 … +50 |
1,85 |
<150 |
|
серебряно-кадмиевый |
Космос, связь, военные технологии |
Ag-Cd |
–30 … +50 |
1,6 |
45 – 90 |
|
цинк-бромный |
|
Zn-Br |
|
1,82 |
70 – 145 |
|
цинк-хлорный |
|
Zn-Cl |
–20 … +30 |
1,98-2,2 |
160 – 250 |
Таблица №1. Классификация аккумуляторных батарей.
Исходя из приведенных данных в таблице №1, можно прийти к выводу, что существует достаточно много видов аккумуляторов, отличных по своим характеристикам, которые оптимизированы для применения в разнообразных условиях и с различной интенсивностью. Применяя для производства новые технологии и компоненты, ученым удается достигать нужных характеристик для конкретной области применения, к примеру, для космических спутников, космических станций и другого космического оборудования были разработаны никель-водородные аккумуляторы. Конечно, в таблице приведены далеко не все типы, а лишь основные, которые получили распространение.
Современные системы резервного и автономного электропитания для промышленного и бытового сегмента основаны на разновидностях свинцово-кислотных, никель-кадмиевых (реже применяются железо-никелевый тип) и литий-ионных аккумуляторах, поскольку эти химические источники питания безопасны и имеют приемлемые технические характеристики и стоимость.
Свинцово-кислотные аккумуляторные батареи
Этот тип является самым востребованным в современном мире по причине универсальных особенностей и невысокой стоимости. Благодаря наличию большого количества разновидностей, свинцово-кислотные аккумуляторы применяется в областях систем резервного питания, системах автономного электроснабжения, солнечных электростанций, ИБП, различных видах транспорта, связи, системах безопасности, различных видах портативных устройств, игрушках и т. д.
Принцип действия свинцово-кислотных батарей
Основа работы химических источников питания основана на взаимодействии металлов и жидкости – обратимой реакции, которая возникает при замыкании контактов положительных и отрицательных пластин. Свинцово-кислотные аккумуляторы, как понятно из названия, состоят из свинца и кислоты, где положительно заряженными пластинами является свинец, а отрицательно заряженными – оксид свинца. Если подключить к двум пластинам лампочку, цепь замкнется и возникнет электрический ток (движение электронов), а внутри элемента возникнет химическая реакция. В частности, происходит коррозия пластин батареи, свинец покрывается сульфатом свинца. Таким образом, в процессе разряда аккумулятора на всех пластинах будет образовываться налет из сульфата свинца. Когда аккумулятор полностью разряжен, его пластины покрыты одинаковым металлом – сульфатом свинца и имеют практически одинаковый заряд относительно жидкости, соответственно, напряжение батареи будет очень низким.
Если к батарее подключить зарядное устройство к соответствующим клеммам и включить его, ток будет протекать в кислоте в обратном направлении. Ток будет вызывать химическую реакцию, молекулы кислоты – расщепляться и за счет этой реакции будет происходить удаление сульфата свинца с положительных и отрицательных пластилин батареи. В финальной стадии зарядного процесса пластины будут иметь первозданный вид: свинец и оксид свинца, что позволит им снова получить разный заряд, т. е. батарея будет полностью заряжена.
Однако на практике все выглядит немного иначе и пластины электродов очищаются не полностью, поэтому аккумуляторы имеют определенный ресурс, по достижении которого емкость снижается до 80-70% от изначальной.

Рисунок №3. Электрохимическая схема свинцово-кислотного аккумулятора (VRLA).
Типы свинцово-кислотных батарей
-
Lead–Acid, обслуживаемые – 6, 12В батареи. Классические стартерные аккумуляторы для двигателей внутреннего сгорания и не только. Нуждаются в регулярном обслуживании и вентиляции. Подвержены высокому саморазряду.
-
Valve Regulated Lead–Acid (VRLA), необслуживаемые – 2, 4, 6 и 12В батареи. Недорогие аккумуляторы в герметизированном корпусе, которые можно использовать в жилых помещениях, не требуют дополнительной вентиляции и обслуживания. Рекомендованы для использования в буферном режиме.
-
Absorbent Glass Mat Valve Regulated Lead–Acid (AGM VRLA), необслуживаемые – 4, 6 и 12В батареи. Современные аккумуляторы свинцово-кислотного типа с абсорбированным электролитом (не жидкий) и стекловолоконными разделительными сепараторами, которые значительно лучше сохраняют свинцовые пластины, не давая им разрушаться. Такое решение позволило значительно снизить время заряда AGM батарей, поскольку зарядный ток может достигать 20-25, реже 30% от номинальной емкости.
Аккумуляторы AGM VRLA имеют множество модификаций с оптимизированными характеристиками для циклического и буферного режимов работы: Deep – для частых глубоких разрядов, фронт-терминальные – для удобного расположения в телекоммуникационных стойках, Standard – общего назначения, High Rate – обеспечивают лучшую разрядную характеристику до 30% и подходят для мощных источников бесперебойного питания, Modular – позволяют создавать мощные батарейные кабинеты и т. д.

Рисунок №4. AGM VRLA аккумуляторы EverExceed.
-
GEL Valve Regulated Lead–Acid (GEL VRLA), необслуживаниемые – 2, 4, 6 и 12В батареи. Одна из последних модификаций свинцово-кислотного типа аккумуляторов. Технология основана на применение гелеобразного электролита, который обеспечивает максимальный контакт с отрицательными и положительными пластинами элементов и сохраняет однообразную консистенцию по всему объему. Данный тип аккумуляторов требует «правильного» зарядного устройства, которое обеспечит требуемый уровень тока и напряжения, лишь в этом случае можно получить все преимущества по сравнению с AGM VRLA типом.
Химические источники питания GEL VRLA, как и AGM, имеют множество подвидов, которые наилучшим образом подходят для определенных режимов работы. Самыми распространенными являются серии Solar – используются для систем солнечной энергии, Marine – для морского и речного транспорта, Deep Cycle – для частых глубоких разрядов, фронт-терминальные – собраны в специальных корпусах для телекоммуникационных систем, GOLF – для гольф-каров, а также для поломоечных машин, Micro – небольшие аккумуляторы для частого использования в мобильных приложениях, Modular – специальное решение по созданию мощных аккумуляторных банков для накопления энергии и т. д.

Рисунок №5. GEL VRLA аккумулятор EverExceed.
-
OPzV, необслуживаемые – 2В батареи. Специальные свинцово-кислотные элементы типа OPZV произведены с применением трубчатых пластин анода и сернокислотным гелеобразным электролитом. Анод и катод элементов содержат дополнительный металл – кальций, благодаря которому повышается стойкость электродов к коррозии и увеличивается срок службы. Отрицательные пластины – намазные, эта технология обеспечивает лучший контакт с электролитом.
Аккумуляторы OPzV устойчивы к глубоким разрядам и обладают длительным сроком службы до 22 лет. Как правило, для изготовления подобных элементов питания применяются только лучшие материалы, чтобы обеспечить высокую эффективность работы в циклическом режиме.
Применение OPzV аккумуляторов востребовано в телекоммуникационных установках, системах аварийного освещения, источниках бесперебойного питания, системах навигации, бытовых и промышленных системах накопления энергии и солнечной электрогенерации.

Рисунок №6. Строение OPzV аккумулятора EverExceed. -
OPzS, малообслуживаемые – 2, 6, 12В батареи. Стационарные заливные свинцово-кислотные аккумуляторы OPzS производятся с трубчатыми пластинами анода с добавлением сурьмы. Катод также содержит небольшое количество сурьмы и представляет собой намазной решетчатый тип. Анод и катод разделены микропористыми сепараторами, которые предотвращают короткое замыкание. Корпус аккумуляторов выполнен из специального ударопрочного, устойчивого к химическому воздействию и огню прозрачного пластика, а вентилируемые клапаны относятся к пожаробезопасному типу и обеспечивают защиту от возможного попадания пламени и искр.
Прозрачные стенки позволяют удобно контролировать уровень электролита при помощи отметок минимального и максимального значения. Специальная структура клапанов дает возможность без их снятия доливать дистиллированную воду и промерять плотность электролита. В зависимости от нагрузки, долив воды осуществляется раз в один – два года.
Аккумуляторные батареи типа OPzS обладают самыми высокими характеристиками среди всех других видов свинцово-кислотных батарей. Срок службы может достигать 20 – 25 лет и обеспечивать ресурс до 1800 циклов глубокого 80% разряда.
Применение подобных батарей необходимо в системах с требованиями среднего и глубокого разряда, в т.ч. где наблюдаются пусковые токи средней величины.

Рисунок №7. OPzS аккумулятор Victron Energy.
Характеристики свинцово-кислотных аккумуляторов
Анализируя приведенные в таблице №2 данные, можно прийти к выводу, что свинцово-кислотные аккумуляторы обладают широким выбором моделей, которые подходят для различных режимов работы и условий эксплуатации.
|
Тип |
LA |
VRLA |
AGM VRLA |
GEL VRLA |
OPzV |
OPzS |
|
Емкость, Ампер/час |
10 – 300 |
1 – 300 |
1 – 3000 |
1 – 3000 |
50 – 3500 |
50 – 3500 |
|
Напряжение, Вольт |
6, 12 |
4, 6, 12 |
2, 4, 6, 12 |
2, 6, 12 |
2 |
2 |
|
Оптимальная глубина разряда, % |
|
30 |
<40 |
<50 |
<60 |
<60 |
|
Допустимая глубина разряда, % |
|
<75 |
<80 |
<90 |
<90 |
<100 |
|
Циклический ресурс, D.O.D.=50% |
|
<250-300 |
<1000 |
<1400 |
<3200 |
<3300 |
|
Оптимальная температура, °С |
0 … +45 |
+15 … +25 |
+10 … +25 |
+10 … +25 |
0 … +30 |
0 … +30 |
|
Диапазон рабочих температур, °С |
–50 … +70 |
–35 … +60 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
–40 … +70 |
|
Срок службы, лет при +20°С |
<7 |
<7 |
5 – 15 |
8 – 15 |
15 – 20 |
17 – 25 |
|
Саморазряд, % |
3 – 5 |
2 – 3 |
1 – 2 |
1 – 2 |
1 – 2 |
1 – 2 |
|
Макс. ток заряда, % от емкости |
10 – 20 |
20 – 25 |
20 – 30 |
15 – 20 |
15 – 20 |
10 – 15 |
|
Минимальное время заряда, ч |
8 – 12 |
6 – 10 |
6 – 10 |
8 – 12 |
10 – 14 |
10 – 15 |
|
Требования к обслуживанию |
3 – 6 мес. |
нет |
нет |
нет |
нет |
1 – 2 года |
|
Средняя стоимость, $, 12В/100Ач. |
70 – 150 |
200 – 250 |
250 – 380 |
350 – 500 |
1000 – 1400 |
1500 – 3500 |
Таблица №2. Сравнительные характеристики по видам свинцово-кислотных батарей.
Для анализа использовались усредненные данные более чем 10-ти производителей батарей, продукция которых представлена на рынке Украины в течение длительного времени и успешно применяется во многих областях (EverExceed, B.B. Battery, CSB, Leoch, Ventura, Challenger, C&D Techologies, Victron Energy, SunLight, Troian и другие).
Литий-ионные (литиевые) аккумуляторные батареи
История прохождения происхождения уходит в 1912 год, когда Гилберт Ньютон Льюис работал над вычислением активностей ионов сильных электролитов и проводил исследования электродных потенциалов целого ряда элементов, включая литий. С 1973 года работы были возобновлены и в результате появились первые элементы питания на основе лития, которые обеспечивали только один цикл разряда. Попытки создать литиевый аккумулятор затруднялись активностью свойств лития, которые при неправильных режимах разряда или заряда вызывали бурную реакцию с выделением высокой температуры и даже пламени. Компания Sony выпустила первые мобильные телефоны с подобными аккумуляторами, но была вынуждена отозвать продукцию обратно после нескольких неприятных инцидентов. Разработки не прекращались и в 1992 году появились первые «безопасные» аккумуляторы на основе ионов лития.
Аккумуляторы литий-ионного типа обладают высокой плотностью энергии и благодаря этому при компактном размере и легком весе обеспечивают в 2-4 раза большую емкость по сравнению со свинцово-кислотными аккумуляторами. Несомненно, большим достоинством литий-ионных батарей является высокая скорость полной 100% перезарядки в течение 1-2 часов.
Li-ion батареи получили широкое применение в современной электронной технике, автомобилестроении, системах накопления энергии, солнечной генерации электроэнергии. Крайне востребованы в высокотехнологичных устройствах мультимедиа и связи: телефонах, планшетных компьютерах, ноутбуках, радиостанциях и т. д. Современный мир сложно представить без источников питания литий-ионного типа.
Принцип действия литиевых (литий-ионных) батарей
Принцип работы заключается в использовании ионов лития, которые связаны молекулами дополнительных металлов. Обычно, в дополнение к литию применяются литийкобальтоксид и графит. При разряде литий-ионного аккумулятора происходит переход ионов от отрицательного электрода (катода) к положительному (аноду) и наоборот при заряде. Схема аккумулятора предполагает наличие разделительного сепаратора между двумя частями элемента, это необходимо для предотвращения самопроизвольного перемещения ионов лития. Когда цепь аккумулятора замкнута и происходит процесс заряда или разряда, ионы преодолевают разделительный сепаратор стремясь к противоположно заряженному электроду.

Рисунок №8. Электрохимическая схема литий-ионного аккумулятора.
Благодаря своей высокой эффективности, литий-ионные аккумуляторы получили бурное развитие и множество подвидов, например, литий-железо-фосфатные аккумуляторы (LiFePO4). Ниже приведена графическая схема работы этого подтипа.

Рисунок №9. Электрохимическая схема процесса разряда и разряда LiFePO4 батареи.
Типы литий-ионных аккумуляторов
Современные литий-ионные аккумуляторы имеют множество подтипов, основная разница которых заключается в составе катода (отрицательно заряженного электрода). Также может изменяться состав анода для полной замены графита или использования графита с добавлением других материалов.
Различные виды литий-ионных аккумуляторов обозначаются по их химическому разложению. Для рядового пользователя это может быть несколько сложно, поэтому каждый тип будет описан максимально подробно, включая его полное название, химическое определение, аббревиатуру и краткое обозначение. Для удобства описания будет использоваться сокращенное название.
-
Литий кобальт оксид (LiCoO2) – Обладает высокой удельной энергией, что делает литий-кобальтовый аккумулятор востребованным в компактных высокотехнологичных устройствах. Катод батареи состоит из оксида кобальта, тогда как анод – из графита. Катод имеет слоистую структуру и во время разряда ионы лития перемещаются от анода к катоду. Недостатком этого типа является относительно короткий срок службы, невысокая термическая стабильность и лимитированная мощность элемента.
Литий-кобальтовые батареи не могут разряжаться и заряжаться током, превосходящим номинальную емкость, поэтому аккумулятор с емкостью 2,4Ач может работать с током 2,4А. Если для заряда будет применяться большая сила тока, то это вызовет перегрев. Оптимальный зарядный ток составляет 0,8C, в данном случае 1,92А. Каждый литий-кобальтовый аккумулятор комплектуется схемой защиты, которая ограничивает заряд и скорость разряда и лимитирует ток на уровне 1C.
На графике (Рис. 10) отражены основные свойства литий-кобальтовых аккумуляторов с точки зрения удельной энергии или мощности, удельная мощность или способность обеспечивать высокий ток, безопасности или шансы воспламенения при высокой нагрузке, рабочая температура окружающей среды, срок службы и циклический ресурс, стоимость.

Рисунок №10. Диаграмма основных свойств LiCoO2 аккумуляторов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
-
Литий Оксид Марганца (LiMn2O4, LMO) – первая информация об использовании лития с марганцевыми шпинелями была опубликована в научных докладах 1983 года. Компания Moli Energy в 1996 году выпустила первые партии аккумуляторов на основе литий-оксид-марганца в качестве материала катода. Такая архитектура формирует трехмерные структуры шпинели, что улучшает поток ионов к электроду, тем самым снижая внутреннее сопротивление и повышая возможные токи заряда. Также преимущество шпинели в термической стабильности и повышенной безопасности, однако циклический ресурс и срок службы ограничен.
Низкое сопротивление обеспечивает возможность быстрого заряда и разряда литий-марганцевого аккумулятора с высоким током до 30А и кратковременно до 50А. Применяется для мощных электроинструментов, медицинского оборудования, а также гибридных и электрических транспортных средств.
Потенциал литий-марганцевых аккумуляторов примерно на 30% ниже по сравнению с литий-кобальтовыми батареями, однако эта технология обладает примерно на 50% лучшими свойствами, чем аккумуляторы на основе никелевых химических компонентов.
Гибкость конструкции позволяет инженерам оптимизировать свойства батареи и достичь длительного срока службы, высокой емкости (удельная энергия), возможности обеспечивать максимальный ток (удельная мощность). Например, с длительным сроком эксплуатации типоразмер элемента 18650 имеет емкость 1,1Ач, тогда как элементы, оптимизированные на повышенную емкость, – 1,5Ач, но при этом они имеют меньший срок службы.
На графике (Рис. 12) отраженны не самые впечатляющие характеристики литий-марганцевых аккумуляторов, однако современные разработки позволили существенно повысить эксплуатационных характеристики и сделать этот тип конкурентным и широко применяемым.









