Анодный протектор. Анодная защита. Классификация методик электрохимической катодной защиты
Мешки для влагопоглотителей всегда поставляются в определенных базовых размерах упаковки, которые, в зависимости от размера блока осушителя, могут содержать один мешок или до 100 мешков. Базовую внешнюю упаковку следует открывать только перед удалением мешка и ее необходимо снова залить теплом.
Сравнение преимуществ и недостатков метода осушителя. Ингибиторы представляют собой вещества, способные подавлять или подавлять химические реакции. Их можно считать противоположными катализаторам, которые позволяют или ускоряют определенные реакции.
Химическая коррозия
Она возникает обычно при воздействии на металлическую структуру сухих газов, жидкостей или растворов, не проводят электрический ток. Суть этого типа коррозии — прямое взаимодействие металла с агрессивной средой. Элементы химически корродируют во время термической обработки или в результате длительной эксплуатации при достаточно высоких температурах. Это касается лопаток газовых турбин, арматуры плавильных печей, деталей двигателей внутреннего сгорания и так далее. В результате на поверхности образуются определенные соединения: оксиды, нитриды, сульфиды.
Катодную защиту от коррозии
Это изменение состояния происходит в значительной степени независимо от обычных температур или уровней влажности. Его тяготение к металлических поверхностей сильнее, чем у молекул воды, что приводит к образованию непрерывного защитного слоя между поверхностью металла и окружающей атмосферой, означает, что водяной пар в атмосфере содержится подальше от поверхности металла, поэтому предотвращение любых коррозия. При определенных обстоятельствах срок действия может продолжаться до двух лет.
Металлические поверхности изделия должны быть максимально чистыми, чтобы обеспечить эффективность метода. Примерно 40 г активных веществ следует допускать на 1 м3 объема воздуха. Целесообразно закрепить этот объем таким образом, чтобы газ не непрерывно удалялся из упаковки из-за движения воздуха. Этого можно достичь, гарантируя, что контейнер максимально герметичный, но герметичное тепловое уплотнение, как и в методе осушителя, не требуется.
Она является следствием контакта металла с жидкой средой, способной проводить электрический ток. Вследствие окисления материал претерпевает структурные изменения, приводящие к образованию ржавчины (нерастворимого продукта), или частицы металла переходят в раствор ионов.
Электрохимическая коррозия: примеры
Ее разделяют на:
Необходимые защитные действия и проблемы совместимости должны быть проверены вместе с производителем. Электрохимическая защита от коррозии, метод активной антикоррозионной защиты металлов, в котором электрооборудования, подлежащего защите, обеспечивается прямым электрическим током, который преобразует или оборудования в катод, или в анод. Если достигается необходимый потенциал защиты, ток коррозии становится меньше, чем при другом потенциале. В случае метода внешнего тока постоянный ток подается с помощью управляемого потенциалом выпрямителя.
- Атмосферную, которая возникает при наличии на поверхности металла жидкостной пленки, в которой газы, содержащиеся в атмосфере (например, О2, СО 2, SO 2), способны растворяться с образованием электролитных систем.
- Жидкостную, которая протекает в токопроводящей жидкой среде.
- Грунтовую, протекающий под влиянием грунтовых вод.
В гальваническом процессе защитный ток подается гальваническими элементами, которые образуются при катодной защиты с помощью тратятся анодов и анодной защиты локальными катодами. Катодную защиту, в которой металл имеет более отрицательный потенциал, чем металл, подлежащей защите, может быть практически применен для защиты сталей, меди, свинца и алюминия во всех почвах и водах. Чаще всего оказывается катодную защиту в подземных трубопроводах, подземных резервуарах, гидротехнических сооружениях и судах.
В защищенных энергетических системах с внешним питанием защитные аноды обычно состоят из железа, графита или легированного платиной титана. Отрицательный полюс источника питания постоянного тока должен быть подключен к защищаемому компонента. Если используемым материалом анода является цинк или магний, которые менее благородные в серии напряжений, чем, например, железо, подлежащей защите, то можно отказаться от внешнего тока, а защитный анод становится активным анодом. Если металл, подлежащей защите, анодно поляризованный внешним током, он помещается в пассивное состояние.
Причины
Поскольку обычно любой металл, который используется для промышленных нужд, не является идеально чистым и содержит включения различного характера, то электрохимическая коррозия металлов возникает вследствие образования на поверхности железа большого количества короткозамкнутых локальных гальванических элементов.
Вальтер Даннекер, Гамбург Профессор Ханс-Гюнтер Десслер, Фрайталь Клаус-Стефан Дрейер, Гамбург Лутц-Карстен ФинЗах, Гросенхайн-Висниц Сандра Гранде, Гейдельберг Профессор Гюнтер Хоффманн, Эберсвальде Профессор Ханс-Дитер Якубко, Лейпциг Профессор Ханс-Петер Клебер, Лейпциг Проф. Рейнхард Крамоловский, Гамбург Вольф Эберхард Краус, Дрезден Вольфганг Либшер, Берлин Анна Шлейцер, Швабский рынок Профессор Хельмут Шмиерс, Фрайберг Проф. Мартина Веншотт, Ганновер Проф. Райнер Вульпиус, Фрайберг Проф. Манфред Вейсенфельса, Дрезден Клаус-Петер Вендландта, Мерзебург Проф.
Появление их может быть связано не только с наличием различных (особенно металлических) примесей (контактное коррозия), но и с неоднородностью поверхности, дефектами кристаллической решетки, механическими повреждениями и тому подобное.
Координация специалиста: Ханс-Дитер Якубко, Рут Карчер. Редактор: Сабина Бартельс, Рут Карчер, Соня Нагель. Электрохимическая защита от коррозии в водоносных системах основана на результатах электрохимии и технических решений для бытовой техники. Они используются в частных домашних хозяйствах и в промышленных условиях. Там, где вода не только течет, но и готова к использованию в металлическом хранилище, неизбежно возникает электрохимическая защита от коррозии, в противном случае неизбежно произойдет коррозия.
Поэтому необходимо принимать систематические меры предосторожности. В первой части этой статьи автор дает представление об основах электрохимической защиты от коррозии. Вторая часть статьи посвящена планированию и выполнению мероприятий по защите от коррозии, а также показывает типичные проблемы в повседневном использовании.
Механизм взаимодействия
Процесс электрохимической коррозии зависит от химического склада материалов и особенностей внешней среды. Если так называемый технический металл покрыт влагой пленкой, то в каждом из указанных гальванических микроэлементов, которые образуются на поверхности, протекают две независимые реакции. Более активный компонент коррозионной пары отдает электроны (например, цинк в паре Zn-Fe) и переходит в жидкую среду в качестве гидратированных ионов (т.е. корродирует) по следующей реакции (анодный процессе):
Водоносные системы используются для транспортировки, хранения и обработки воды, особенно для отопления. Это стало, конечно, во многих частях мира. Центральным элементом водоносных систем является водонагреватель. Техническое решение для подогрева и поддержания воды имеет две основные проблемы: во-первых, чтобы поддерживать память функционально и экономически, а во-вторых, для защиты здоровья пользователей. Это особенно актуально для современных высокоэнергетических систем хранения, данных со сложными функциями, такими как хранение солнечной батареи или стратифицированное хранилище.
М + nH 2 O = M z + * nH 2 O + ze.
Эта часть поверхности является отрицательным полюсом локального микроэлемента, где металл электрохимических растворяется.
На менее активном участке поверхности, является положительным полюсом микроэлемента (железо в паре Zn-Fe), электроны связываются за счет протекания реакции восстановления (катодный процесс) по схеме:
Основные требования к водонагревателей. Устойчивость к утечке в результате разрушения материала, отсутствие ухудшения эксплуатационной функции отложений или загрязнения водой твердыми продуктами коррозии. Отсутствие ухудшения качества питьевой воды из-за коррозионных реакций.
Ионные движения и реакции катодной защиты от коррозии: анод магния высвобождает электрический заряд, который протекает через внешнюю ведущую цепь к подлежащим защите объекта. Изменение условий заряда приводит к значительному снижению скорости коррозии. Ионы железа на стенке сосуда не просачиваются.
Таким образом, наличие окислителей в водяной пленке, которые способны связывать электроны, обеспечивает возможность дальнейшего хода анодного процесса. Соответственно, электрохимическая коррозия может развиваться только при условии одновременного протекания как анодного, так и катодного процессов. Вследствие торможения одного из них скорость окисления уменьшается.
Стресс серии металлов в водопроводной воде. В зависимости от области применения качество воды может быть очень разным, в частности, электропроводности или содержания антикоррозионных солей и других составляющих воды. Ориентация через правила и стандарты. В области хранения, в промышленных и кустарных приложениях, обычно используется катодная защита от коррозии. Широкий набор стандартов для защиты от катодной коррозии был разработан на основе практического применения и лабораторных исследований.
Они имеют решающее значение для работы контейнера. Он состоит из пяти частей информации о медных и медных сплавах, горячеоцинкованных черных материалах, нержавеющих сталях и чугунных, нелегированных и низколегированных сталях. Важно отметить возможные отклонения для действующих вод, которые являются более физиологическими, чем те, которые рассматриваются в стандарте. Производители и операторы систем вместе со специалистами из катодной защиты от коррозии постоянно разрабатывают новые решения, в которых пока нет спецификаций.
Процесс поляризации
Оба вышеуказанных процесса вызывают поляризацию соответствующих полюсов (электродов) микроэлемента. Какие здесь есть особенности? Обычно электрохимическая коррозия металлов более существенно замедляется поляризацией катода. Поэтому она будет усиливаться под влиянием факторов, которые предотвращают эту реакцию и сопровождаются так называемой деполяризацией положительного электрода.
Значения потенциалов защиты от стандартного водородного электрода. Пояснение: Для обеспечения эффективности электрохимической защиты от коррозии необходим защитный потенциал должен быть поднутрения. Для некоторых металлов нижней критический потенциал нельзя подрезать, не отказываясь от защиты. На этой основе контейнерные плиты измеряют катодную защиту от коррозии.
Протекторная защита металла
Принцип катодной защиты от коррозии. Принцип основан на электрохимических реакциях с движением ионов в внутренней части памяти и потоке электрического тока во внешнем круге. Коррозионная предрасположенность — это стенка контейнера. При катодной коррозионной защиты он «обращается» на катод. Для этой цели дополнительно вводят в действие защитный блок анода. Этот защитный блок может быть, например, гальваническим анодом. Материалами для этого есть магний, алюминий или цинк. По физиологическим и электрохимическим причин только магниевые аноды имеют право на питьевую воду.
Во многих коррозионных процессах катодный деполяризация осуществляется разрядом ионов водорода или восстановлением молекул воды и соответствует формулам:
- В кислой среде: 2Н + + 2е = Н2.
- В щелочной: 2Н 2 О + 2е = Н2 + 2ОН -.
диапазон потенциалов
Потенциал, который соответствует этим процессам, в зависимости от природы агрессивной среды, может изменяться от -0,83 до 0 В. Для нейтрального водного раствора при температурах, близких к стандартной, он равен примерно -0,41 В., Следовательно, ионы водорода, содержатся в воде и в нейтральных водных системах, могут окислять только металлы с потенциалом, меньшим, чем -0,41 в (расположены в ряду напряжений до кадмия). Учитывая то, что некоторые из элементов защищены оксидной пленкой, число металлов, склонных к окислению в нейтральных средах ионами водорода, незначительное.
В результате электрохимическая поляризация происходит на контактирует с водой металлической поверхности памяти. Это приводит к остановке коррозии — при условии правильной настройки. Частичные реакции показаны в обзоре «Движения ионов». Хранение становится катодом. Контактирует с водой поверхность хранения представляет собой катод, контактирует с магниевым анодом. Веществом, вызывающим коррозию, является молекулярный кислород, растворенный в воде. Он направляет свою атаку без защитной меры железом стены хранилища.
В этом случае образуются оксиды железа, то есть ржавчина. Движущей силой для коррозии является катодная частичная реакция восстановления кислорода. Если стенка для хранения приводится в контакт с металлом, который менее благородный, чем сталь, то атака кислорода на железный материал стенки контейнера опущена. Такими менее благородными материалами, например, магний, цинк или алюминий. Из них могут быть изготовлены гальванические защитные аноды. Носители заряда, необходимые для катодного восстановления кислорода, затем предоставляются защитным анодом, а не стенкой для хранения.
Если влага пленка содержит растворенный кислород воздуха, то он способен, в зависимости от характера среды, связывать электроны эффектом кислородной деполяризации. В этом случае схема электрохимической коррозии выглядит следующим образом:
- В 2 + 4е + 2Н 2 О = 4ОН — или
- В 2 + 4е + 4Н + = 2Н 2 О.
Потенциалы указанных электродных реакций при температурах, близких к стандартной, меняются от 0,4 В (щелочная среда) до 1,23 В (кислая среда). В нейтральных средах потенциал процесса восстановления кислорода при указанных условиях соответствует значению 0,8 В., Следовательно, растворенный кислород способен окислять металлы с потенциалом менее 0,8 В (расположены в ряду напряжений до серебра).
Таким образом, реакция коррозии перенаправляется на анод, который жертвует материалом во времени — и поэтому также упоминается как жертвенный анод. Он предназначен для легкого снятия и замены в таком случае. На защищенном объекте металлическая накопительная стенка возникает в результате электрохимических процессов для изменения условий электрического заряда. Потенциал электрохимической стенки уменьшается, так что скорость коррозии замедляется на порядок. Сдвиг электрохимического потенциала на более отрицательный, то есть более катодный, значение, в конечном счете ответственность за ингибирования коррозии, дает название процесса: катодная защита от коррозии.
Важнейшие окислители
Виды электрохимической коррозии характеризуются окислительными элементами, важнейшими из которых являются ионы водорода и кислород. При этом пленка, которая содержит растворенный кислород, в коррозионном отношении значительно опаснее, чем влага, где кислорода нет, и которая способна окислять металлы исключительно ионами водорода, так как в последнем случае количество видов материалов, способных корродировать, значительно меньше.
В зависимости от комбинации металлического материала резервуара-накопителя и воды требуются различные защитные потенциалы. Необходимые защитные потенциалы для других комбинаций можно найти в таблице. Принципы применения катодной защиты от коррозии. Для эффективной работы катодной защиты от коррозии необходимо выполнить требования. В области коммерческих водонагревателей с эмалировкой они относятся прежде всего к долговечности эмали, проводимости среды и защитного объекта, а также к распределению защитного тока.
В принципе, также возможно защитить полностью непокрытые контейнерные конструкции из нелегированной стали в качестве основного материала. Однако для этого нужны большие аноды с высокой стоимостью, а срок службы таких анодов был бы относительно коротким. По этой причине на практике используются эмалированные воспоминания. Эмали — это электрический изолятор, похожий на стекло. Однако на практике слои эмали всегда проявляют признаки износа. Защита этих точек слива на поверхности эмали является важной задачей катодной защиты.
Например, в стали и в чугуне присутствуют примеси углерода преимущественно в виде карбида железа Fe 3 C. В этом случае механизм электрохимической коррозии с водородной деполяризацией для указанных металлов выглядит следующим образом:
- (-) Fe — 2e + nH 2 O = Fe 2+ · nH 2 O (может образовываться ржавчина)
- (+) 2Н + + 2е = Н2 (в подкисленной среде)
- (+) 2Н 2 О + 2е = Н2 + 2ОН — (в нейтральной и щелочной среде).
Механизм коррозии железа, в котором содержатся примеси меди, при кислородной деполяризации катода описывается уравнениями:
- (-) Fe — 2e + nH 2 O = Fe 2+ · nH 2 O;
- (+) 0,5о 2 + Н 2 О + 2е = 2ОН — (в подкисленной среде)
- (+) 0,5о 2 + 2Н + + 2е = Н 2 О (в нейтральной и щелочной среде).
Электрохимическая коррозия протекает с разной скоростью. Этот показатель зависит от:
- разности потенциалов между полюсами гальванического микроэлемента;
- состава и свойств электролитный среды (рН, наличие ингибиторов и стимуляторов коррозии)
- концентрации (интенсивности подачи) окислителя;
- температуры.
Методы защиты
Электрохимическая защита металлов от коррозии достигается следующими способами:
- Созданием антикоррозионных сплавов (легированием).
- Увеличением чистоты индивидуального металла.
- Нанесением на поверхность различных защитных покрытий.
Эти покрытия в свою очередь бывают:
- Неметаллическими (краски, лаки, смазочные материалы, эмали).
- Металлическими (анодные и катодные покрытия).
- Образованными специальной обработкой поверхностей (пассивация железа в концентрированных серной или азотной кислоты железа, никеля, кобальта, магния в растворах щелочей; образование оксидной пленки, например, на алюминии).
Металлическое защитное покрытие
Наиболее интересной и перспективной является электрохимическая защита от коррозии другим видом металла. По характеру защитного характера металлизированные покрытия подразделяют на анодные и катодные. Остановимся на этом моменте подробнее.
Анодным называется покрытие, образованное более активным (менее благородным) металлом, чем тот, что защищают. То есть осуществляется защита элементом, который стоит в ряду напряжений до основного материала (например, покрытие железа цинком или кадмием). При местных разрушения защитного слоя корродировать будет менее благородный металл-покрытие. В зоне царапин и трещин образуется локальный гальванический элемент, катодом в котором есть ограждений металл, а анодом — покрытие, которое окисляется. Целостность такой защитной пленки значения не имеет. Однако чем она толще, тем медленнее будет развиваться электрохимическая коррозия, дольше будет продолжаться положительный эффект.
Катодных называется покрытие металлом с большим потенциалом, который в ряду напряжений стоит после защищается (например, напыление низколегированных сталей медью, оловом, никелем, серебром). Покрытие должно быть сплошным, так как при его повреждении образуются локальные гальванические элементы, в которых основной металл будет анодом, а защитный слой — катодом.
Как уберечь металл от окисления
Электрохимическая защита от коррозии подразделяется на два типа: протекторный и катодный. Протекторная аналогичная анодной покрытию. К материалу, который нужно защитить, присоединяют большую пластину более активного сплава. Образуется гальванический элемент, основной металл в котором служит катодом, а протектор — анодом (он корродирует). Обычно для этого типа защиты применяют цинк, алюминий или сплавы на основе магния. Протектор постепенно растворяется, поэтому его нужно периодически заменять.
Много неприятностей в коммунальном хозяйстве и в промышленности в целом приносит электрохимическая коррозия трубопроводов. В борьбе с ней наиболее подходит метод катодной поляризации. Для этого металлическая конструкция, которая защищается от разрушительных процессов окисления, подключается к отрицательному полюсу любого внешнего источника постоянного тока (она после этого становится катодом, при этом возрастает скорость выделения водорода, а скорость коррозии снижается), а к положительному полюсу присоединяют малоценный металл .
Электрохимические методы защиты эффективны в токопроводящей среде (яркий пример — морская вода). Поэтому протекторы часто используют, чтобы защитить подводные части морских судов.
Обработка агрессивной среды
Этот метод является эффективным, когда электрохимическая коррозия железа протекает в небольшом объеме токопроводящей жидкости. Справиться с разрушительными процессами в этом случае можно двумя способами:
- Удалением из жидкости кислорода (деаэрация) в результате продувки инертным газом.
- Введением в среду ингибиторов — так называемых замедлителей коррозии. Например, в случае если поверхность разрушается в результате окисления кислородом, добавляют органические вещества, молекулы которых содержат определенные аминокислоты (имино-, тио и другие группы). Они хорошо адсорбируются на поверхности металла и существенно снижают скорость электрохимических реакций, приводящих к разрушениям поверхностного контактного слоя.
Вывод
Безусловно, коррозия химическая и электрохимическая приносит значительный ущерб и в промышленности, и в быту. Если бы металл не корродировать, срок службы многих предметов, деталей, агрегатов, механизмов значительно увеличился бы. Сейчас ученые активно разрабатывают альтернативные материалы, способные заменить металл, не уступают по эксплуатационным характеристикам, однако полностью отказаться от его применения в ближайшей перспективе, наверное, невозможно. В этом случае на первый план выходят передовые методы защиты металлических поверхностей от коррозии.
Среди всех существующих видов разрушения металлов наиболее часто встречается электрохимическая коррозия, которая возникает в результате его взаимодействия с электролитически проводящей средой. Основная причина этого явления — это термодинамическая неустойчивость металлов в средах, которые их окружают.
Этому виду коррозии подвержены многие объекты и конструкции:
- газовые и водные трубопроводы;
- элементы транспортных средств;
- другие конструкции, изготовленные из металла.
Коррозионные процессы, то есть, ржавчина, могут возникать в атмосфере, в почве, а также в соленой воде. Очистка металлоконструкций от проявлений электрохимической коррозии является сложным и длительным процессом, поэтому проще предотвратить ее возникновение.
Основные разновидности
При коррозии в электролитах происходит преобразование химической энергии в электрическую. В связи с этим ее называют электрохимической. Принято различать следующие виды электрохимической коррозии.
межкристаллитная
Во межкристаллитной коррозией подразумевается такое опасное явление, при котором происходит разрушение границ зерна никеля, алюминия и других металлов избирательным образом. Как следствие, прочностные и пластические свойства материала теряются. Главная опасность этого вида коррозии в том, что далеко не всегда она заметна визуально.
язвенная
Язвенная электрохимическая коррозия является точечная поражение отдельных участков поверхности меди и других металлов. В зависимости от характера поражения, различают закрытый, открытый, а также поверхностный питтинг. Размеры пораженных участков могут варьироваться от 0,1 мм до 1,5 мм.
щелевая
Щелевой электрохимической коррозией принято называть усиленный процесс разрушения металлических конструкций в местах расположения щелей, зазоров и трещин. Течение щелевой коррозии может происходить в воздушной атмосфере, газовых смесях, а также морской воде. Данный вид разрушения характерен для газопроводов, днищ морских судов и многих других объектов.
Распространена протекания коррозии в условиях небольшого количества окислителя через затрудненного подхода к стенкам щели. Это приводит к накоплению коррозионных продуктов внутри зазоров. Электролит, содержащийся во внутреннем пространстве зазора, может изменяться под влиянием гидролиза продуктов коррозии.
С целью защиты металлов от щелевой коррозии принято применять несколько методов:
- уплотнения зазоров и щелей;
- электрохимическая защита;
- процесс ингибирования.
В качестве профилактических методов следует использовать только те материалы, которые в наименьшей степени подвержены возникновению ржавчины, а также сначала грамотно и рационально конструировать газопроводы и другие важные объекты.
Грамотная профилактика во многих случаях является более простой процесс, чем дальнейшая очистка металлоконструкций от въевшейся ржавчины.
Как проявляется коррозия различных видов
В качестве примера протекания коррозионного процесса можно привести разрушение различных приборов, компонентов автомобилей, а также любых конструкций, изготовленных из металла и расположенных:
- в атмосферном воздухе;
- в водах — моря, реки, содержащиеся в почве и под слоями почвы;
- в технических средах и т.д.
В процессе ржавления металл становится многоэлектронных гальваническим элементом. Так, например, если в электролитической среде происходит контакт меди и железа, медь является катодом, а железо — анодом. Отдавая электроны меди, железо в виде ионов попадает в раствор. Ионы водорода начинают двигаться по направлению к меди и там разряжаются. Становясь все более и более отрицательным, катод вскоре приравнивается к потенциалу анода, в результате чего коррозионный процесс начинает замедляться.
Различные виды коррозии проявляются по-разному. Более интенсивно электрохимическая коррозия проявляется в тех случаях, когда в катоде присутствуют вкрапления металла с меньшей активностью по сравнению с корродируют — на них ржавчина появляется быстрее и достаточно выразительной.
Ход атмосферной коррозии происходит в условиях влажного воздуха и температуре. В данном случае на поверхности металла образуется пленка из воды с растворенным кислородом. Процесс разрушения металла становится интенсивнее по мере увеличения влажности воздуха и содержания газообразных оксидов углерода и серы при наличии:
- трещин;
- шероховатостей;
- других факторов, провоцирующих облегчения процесса конденсации.
-
Почвенная коррозия в наибольшей степени поражает различные подземные сооружения, газопроводы, кабели и другие конструкции. Разрушение меди и других металлов происходит из-за их тесного контакта с почвенной влагой, в составе которой также присутствует растворенный кислород. Разрушение трубопроводов может произойти уже через полгода с момента их строительства в том случае, если для почвы, в которой они установлены, характерна повышенная кислотность.
Под влиянием блуждающих токов, исходящих от посторонних объектов, возникает электрическая коррозия. Ее главными источниками являются электрические железные дороги, линии электропередач, а также специальные установки, которые функционируют на постоянной электротоком. В большей степени данный вид коррозии провоцирует разрушение:
- газопроводов;
- всевозможных сооружений (мосты, ангары)
- электрокабелей;
- нефтепроводов.
Действие тока провоцирует возникновение участков входа и выхода электронов — то есть, катодов и анодов. Наиболее интенсивным разрушительный процесс является именно на участках с анодами, поэтому на них ржавчина более заметна.
Коррозия отдельных компонентов газопроводов и водных трубопроводов может быть вызвана тем, что процесс их установки является смешанным, то есть, происходит с использованием различных материалов. Наиболее частыми примерами являются точечная коррозия, возникающая в элементах из меди, а также коррозия биметаллов. При смешанной установки железных элементов со сплавами меди и цинка, процесс коррозии отличается меньшей степенью критичности, чем при медном литье, то есть со сплавами меди, цинка и олова. Предотвратить коррозию трубопроводов можно, используя специальные методы.
Способы защиты от ржавления
Для борьбы с коварной ржавчиной применяются различные методы. Рассмотрим те из них, который является наиболее эффективными.
способ №1
Один из самых популярных методов — это электрохимическая защита чугуна, стали, титана, меди и других металлов. На чем же она основывается?
Электрохимическая обработка металлов представляет собой особый способ, направленный на изменение формы, размеров и шероховатости поверхности путем анодного растворения в электролите под воздействием электротока.
Чтобы обеспечить надежную защиту от ржавчины, необходимо еще перед началом эксплуатации металлических изделий обрабатывать их особым средствами, которые в своем составе содержат различные компоненты органического и неорганического происхождения. Данный метод позволяет предотвратить появление ржавчины на время, однако позже придется обновлять покрытие.
Электрозащита представляет собой процесс, при котором металлическая конструкция подключается к внешнему источнику постоянного тока. В результате этого на ее поверхности формируется поляризация электродов катодной типа, и все анодные области начинают превращаться в катодные.
Электрохимическая обработка металлов может происходить с участием анода или катода. В некоторых случаях происходит поочередное обработка металлического изделия обеими электродами.
Катодную защиту от коррозии необходима в тех ситуациях, когда у металла, подлежащего защите, не наблюдается склонность к пассивации. К металлического изделия подключается источник внешнего тока — специальная станция катодной защиты. Данный метод подходит для защиты газопроводов, а также трубопроводов водоснабжения и отопления. Однако есть у этого метода определенные недостатки в виде растрескивания и разрушения защитных покрытий — это происходит в случаях значительного смещения потенциала объекта в отрицательную сторону.
способ №2
Электроискровая обработка металлов может осуществляться с помощью установок различных типов — бесконтактной, контактной, а также анодно-механической.
способ №3
Для надежной защиты газопроводов и других трубопроводов от ржавчины часто применяется такой метод, как электродуговая напыления. Преимущества данного способа очевидны:
- значительная толщина защитного слоя;
- высокий уровень производительности и надежности;
- применения относительно недорогого оборудования;
- несложный технологический процесс;
- возможность применения автоматизированных линий;
- невысокие энергетические затраты.
Среди недостатков данного метода — невысокая эффективность при обработке конструкций в коррозионных средах, а также недостаточная прочность сцепления со стальной основой в некоторых случаях. В любых других ситуациях такая электрозащиту очень эффективна.
способ №4
Для защиты различных металлических конструкций — газопроводов, мостовых сооружений, различных трубопроводов — нужна эффективная антикоррозийная обработка.
Данная процедура осуществляется в несколько этапов:
- тщательное удаление жировых отложений и масел с применением эффективных растворителей;
- очистки обрабатываемой поверхности от солей, растворимых в воде, — выполняется с помощью профессиональных аппаратов высокого давления;
- удаление имеющихся конструкционных ошибок, выравнивания кромок — это необходимо для предотвращения сколов наносится лакокрасочного покрытия;
- тщательную очистку поверхности с помощью пескоструйного аппарата — это делается не только для удаления ржавчины, но и для придания нужной степени шероховатости;
- нанесение антикоррозийного материала и дополнительного защитного слоя.
Правильная предварительная обработка газопроводов и всевозможных металлоконструкций обеспечит им надежную защиту от электрохимической коррозии в процессе эксплуатации.
Электрохимическая защита от коррозии — это… Что такое Электрохимическая защита от коррозии?
- Электрохимическая защита от коррозии
Электрохимическая защита от коррозии
Электрохимическая защита от коррозии — бывает анодная и катодная.
Катодная защита
При катодной защите защищаемый объект соединяют с отрицательным электродом источника ЭДС — он становится катодом.
Анодная защита
При анодной защите, соответственно, наоборот — защищаемый объект становится анодом. Анодная защита основана на явлении пассивации и может быть применена не во всех случаях.
Wikimedia Foundation. 2010.
- Шереметев, Иван Петрович
- Янов, Юрий Николаевич
Смотреть что такое «Электрохимическая защита от коррозии» в других словарях:
Электрохимическая защита от коррозии — Электрохимическая защита защита металла от коррозии, осуществляемая поляризацией от внешнего источника тока или путем соединения с металлом (протектором), имеющим более отрицательный потенциал, чем у защищаемого металла… Источник: ИНСТРУКЦИЯ ПО … Официальная терминология
ЭЛЕКТРОХИМИЧЕСКАЯ ЗАЩИТА от коррозии — воздействие непосредственно на электрохимическую кинетику коррозионных процессов в морской воде путем катодной поляризации смещения потенциала в отрицательную сторону до определения значений электрического тока, при которых вся защищаемая… … Морской энциклопедический справочник
Электрохимическая защита — защита металлов от коррозии, осуществляемая поляризацией от внешнего источника тока или путем соединения с металлом (протектором), имеющим более отрицательный потенциал, чем у защищаемого металла. Источник: snip id 5429: Руководство по… … Словарь-справочник терминов нормативно-технической документации
Защита от коррозии — (антикоррозионная защита) – способы и средства, предотвращающие или уменьшающие коррозию бетонных или железобетонных конструкций, арматуры. [Терминологический словарь по бетону и железобетону. ФГУП «НИЦ «Строительство» НИИЖБ им. А. А.… … Энциклопедия терминов, определений и пояснений строительных материалов
электрохимическая защита — Защита металла от коррозии, осуществляемая поляризацией от внешнего источника тока или путем соединения с металлом (протектором), имеющим более отрицательный или более положительный потенциал, чем у защищаемого металла. Примечание В зависимости… … Справочник технического переводчика
Электрохимическая защита трубопроводов — (a. electrochemical protection of pipeline; н. elektrochemischer Schutz von Rohrleitungen; ф. protection electrochimique des tuyauteries, traitement electrochimique des conduites; и. proteccion electroquimica de tuberia) анодная или… … Геологическая энциклопедия
Защита от коррозии первичная — – электрохимическая защита стальной арматуры, осуществляемая от внешнего источника тока или путем соединения с металлом, имеющим более отрицательный потенциал, чем у стальной арматуры в бетоне. [Терминологический словарь по бетону и… … Энциклопедия терминов, определений и пояснений строительных материалов
электрохимическая защита поверхности — (напр. от коррозии) [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN coating electrochemical protection … Справочник технического переводчика
ЗАЩИТА ОТ КОРРОЗИИ — конструкционных материалов в агрессивных средах основана на: 1) повышении коррозионной стойкости самого материала; 2) снижении агрессивности среды; 3) предотвращении контакта материала со средой с помощью изолирующего покрытия; 4) регулировании… … Химическая энциклопедия
электрохимическая защита — [sacrificial protection] защита от коррозии регулированием поляризации корродирующей поверхности внешним электронным током, который подводится от вспомогательного электрода. В зависимости от направления поляризующего тока различают анодную и… … Энциклопедический словарь по металлургии
Электрохимическая защита катодная и анодная
Электрохимическая защита — катодная и применение протекторов анодная электрохимическая защита и защита от блуждающих токов применением электродренажа. [c.5]
Принципы электрохимической защиты сводятся к наложению на подземный трубопровод катодного тока от постороннего источника тока такой величины, что вся поверхность трубопровода становится катодной и в анодной зоне нет стекающих коррозионных токов. [c.17]
Дальнейшим развитием метода анодной электрохимической защиты является анодно-протекторная защита, когда наряду с внешним источником тока используют катодные протекторы, имеющие более положительный потенциал. [c.144]
Применение катодной защиты целесообразно для защиты внутренней поверхности трубок и внутренней поверхности кожуха теплообменников. При этом условия электрохимической защиты зависят также от количества В среде продуктов анодной реакции. Количество этих продуктов определяется площадью защищаемой поверхности, Так, пр и стальном аноде продуктом анодной реакции является РегОз, а количество его составляет 99,4 мг/м -ч. При значительных расходах воды концентрации этих продуктов могут быть незначительными и не будут оказывать влияние на качество воды. [c.208]
Анодными называются защитные металлические покрытия, которые в данной коррозионной среде обнаруживают потенциал более электроотрицательный, чем потенциал основного металла. Примерами анодных покрытий являются цинковые, алюминиевые и кадмиевые покрытия на стали, работающей в морской воде. Они служат и механической и электрохимической защитой. Повреждение анодного покрытия или наличие в нем пор не вызывают коррозии основного металла (стали), а способствуют разрушению самого покрытия (например, цинка). Растворение цинка вызывает катодную поляризацию стали, препятствуя ее коррозии. [c.57]
При электрохимической защите от коррозии резервуаров, сосудов—реакторов, транспортных устройств или трубопроводов в химической и нефтеперерабатывающей промышленности часто приходится иметь дело со средами высокой коррозионной активности. Здесь встречаются среды начиная от обычной пресной и более или менее загрязненной речной, солоноватой и морской воды (часто применяемые для охлаждения) или реакционных растворов и сточных вод химического производства и кончая крепкими рассолами, которые нужно хранить и транспортировать при добыче нефти. Целесообразно ли даже при наличии существенных коррозионных влияющих факторов опробовать электрохимическую защиту и какой именно способ лучше всего можно применить — это зависит от конкретных условий в каждом отдельном случае. Так, при наличии материалов, поддающихся пассивации в соответствующих средах, кроме известной катодной защиты может ставиться вопрос и о применимости анодной защиты. Этот способ можно успешно применить в тех случаях, когда потенциал свободной коррозии ввиду слишком слабого окислительного действия среды располагается в области активной коррозии, но при наложении анодного тока от постороннего источника может быть легко смещен в область пассивности и поддержан на этом уровне (см. раздел 2.3.1.2 и рис. 2.12). [c.378]
Электрохимическая защита. Электрохимическая защита основана на уменьшении коррозии путем катодной или анодной поляризации защищаемой конструкции. В соответствии с этим различают два вида электрохимической защиты катодную и протекторную. [c.75]
Применять методы электрохимической защиты от коррозии начали в первую очередь в химической промышленности около 15 лет назад вначале нерешительно, как это было и с применением катодной защиты подземных трубопроводов около 30 лет назад. Препятствие к более щирокому применению заключалось главным образом в том, что внутренняя защита должна в большей мере выполняться по индивидуальным проектам, чем простая наружная защита подземных сооружений. В связи с возросшей важностью обеспечения повышенной надежности производственных установок, с ужесточением требований к коррозионной стойкости и укрупнением деталей и узлов установок начал проявляться интерес к электрохимической внутренней защите. Хотя на вопрос об экономичности защиты нельзя дать общего ответа (см. раздел 22.4), все же очевидно, что расходы на электрохимическую защиту будут меньше расходов на высококачественную и надежную футеровку (на покрытия) или на коррозионностойкие материалы. При этом анализе нельзя не отметить, что наде кная эксплуатация очень крупных выпарных аппаратов для щелочных растворов вообще стала возможной только благодаря применению внутренней анодной защиты, поскольку достаточно эффективный отжиг для снятия внутренних напряжений крупных резервуаров практически неосуществим, а конструктивные и эксплуатационные напряжения вообще не могут быть устранены. [c.400]
Электрохимическая защита состоит в том, что при смещении электродного потенциала металла коррозионные процессы тормозят
Вопрос 41. Способы защиты металлов от коррозии. Электрохимическая защита. Протекторная защита и катодная защита.
Коррозией металлов (лат. сorrosio — разъедание) называется самопроизвольный процесс разрушения металлов под действием окружающей среды. В зависимости от используемого материала, назначения, условий эксплуатации, требований по надежности, технических возможностей и экономичности в настоящее время применяют различные методы борьба с коррозией. Важнейшие среди них: Рациональное конструирование. Выбор коррозионно-стойких материалов. Применение защитных покрытий. Обработка коррозионно агрессивной среды. Электрохимическая защита.
Одним из наиболее эффективных способов защиты металлов от коррозии является электрохимическая защита. Используя ее, можно предупредить разрушение трубопроводов, корпусов судов буровых платформ, резервуаров, реакционных аппаратов и др. Сущность электрохимической защиты заключается в наложении внешнего тока, поляризующего катодные участки локальных элементов на поверхности металла до потенциала неполяризованных анодных участков. Поверхность защищаемого изделия становится эквипотенциальной (потенциалы катодных и анодных участков равны) и катодной по отношению к специально присоединенному для обеспечения поляризации аноду. При этом разрушаться будет присоединенный анод, а на защищаемом изделии будут протекать не вызывающие убыли массы и разрушения металла катодные процессы.
Электрохимическая защита подразделяется на гальваническую (протекторную) и анодную. При гальваническую защите, (рис) к защищаемому объекту присоединяют специальный анод — протектор “жертвенный анод” с более отрицательной величиной электродного потенциала.
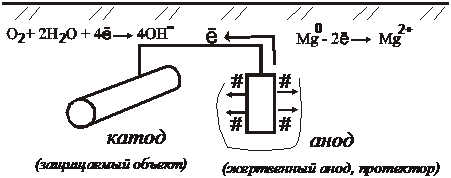
Катодная защита — это электрохимическая защита, основанная на наложении отрицательного потенциала на защищаемую деталь. Сдвиг потенциала защищаемого металлического объекта осуществлен с помощью внешнего источника постоянного тока (станции катодной защиты) или соединением с протекторным анодом, изготовленным из металла более электроотрицательного, относительно объекта. При этом поверхность защищаемого образца (детали конструкции) становится эквипотенциальной и на всех её участках протекает только катодный процесс.
Протекторная защита является разновидностью катодной защиты. К защищаемой конструкции присоединяют более электроотрицательный металл — протектор — который, растворяясь в окружающей среде, защищает от разрушения основную конструкцию. После полного растворения протектора или потери контакта с защищаемой конструкцией, протектор необходимо заменить
Защита от коррозии металла: катодная, анодная, покрытия
Металлы используются человеком с доисторических времен, изделия из них широко распространены в нашей жизни. Самым распространенным металлом является железо и его сплавы. К сожалению, они подвержены коррозии, или ржавлению — разрушению в результате окисления. Своевременная защита от коррозии позволяет продлить срок службы металлических изделий и конструкций.

 Защита от коррозии
Защита от коррозииВиды коррозии
Ученые давно борются с коррозией и выделили несколько основных ее типов:
- Атмосферная. Происходит окисление вследствие контакта с кислородом воздуха и содержащимися в нем водяными парами. Присутствие в воздухе загрязнений в виде химически активных веществ ускоряет ржавление.
- Жидкостная. Проходит в водной среде, соли, содержащиеся в воде, особенно морской, многократно ускоряют окисление.
- Почвенная. Этому виду подвержены изделия и конструкции, находящиеся в грунте. Химический состав грунта, грунтовые воды и токи утечки создают особую среду для развития химических процессов.
Исходя из того, в какой среде будет эксплуатироваться изделие, подбираются подходящие методы защиты от коррозии.
Характерные типы поражения ржавчиной
Различают следующие характерные виды поражения коррозией:
- Поверхность покрыта сплошным ржавым слоем или отдельными кусками.
- На детали возникли небольшие участки ржавчины, проникающей в толщину детали.
- В виде глубоких трещин.
- В сплаве окисляется один из компонентов.
- Глубинное проникновение по всему объему.
- Комбинированные.


Виды коррозионных разрушений
По причине возникновения разделяют также:
- Химическую. Химические реакции с активными веществами.
- Электрохимическую. При контакте с электролитическими растворами возникает электрический ток, под действием которого замещаются электроны металлов, и происходит разрушение кристаллической структуры с образованием ржавчины.
Коррозия металла и способы защиты от нее
Ученые и инженеры разработали множество способов защиты металлических конструкций от коррозии.
Защита от коррозии индустриальных и строительных конструкций, различных видов транспорта осуществляется промышленными способами.
Зачастую они достаточно сложные и дорогостоящие. Для защиты металлических изделий в условиях домовладений применяют бытовые методы, более доступные по цене и не связанные со сложными технологиями.
Промышленные
Промышленные методы защиты металлических изделий подразделяются на ряд направлений:
- Пассивация. При выплавке стали в ее состав добавляют легирующие присадки, такие, как Cr, Mo, Nb, Ni. Они способствуют образованию на поверхности детали прочной и химически стойкой пленки окислов, препятствующей доступу агрессивных газов и жидкостей к железу.
- Защитное металлическое покрытие. На поверхность изделия наносят тонкий слой другого металлического элемента — Zn , Al, Co и др. Этот слой защищает железо о т ржавления.
- Электрозащита. Рядом с защищаемой деталью размещают пластины из другого металлического элемента или сплава, так называемые аноды. Токи в электролите текут через эти пластины, а не через деталь. Так защищают подводные детали морского транспорта и буровых платформ.
- Ингибиторы. Специальные вещества, замедляющие или вовсе останавливающие химические реакции.
- Защитное лакокрасочное покрытие.
- Термообработка.


Порошковая покраска для защиты от коррозии
Способы защиты от коррозии, используемые в индустрии, весьма разнообразны. Выбор конкретного метода борьбы с коррозией зависит от условий эксплуатации защищаемой конструкции.
Бытовые
Бытовые методы защиты металлов от коррозии сводятся, как правило, к нанесению защитных лакокрасочных покрытий. Состав их может быть самый разнообразный, включая:
- силиконовые смолы;
- полимерные материалы;
- ингибиторы;
- мелкие металлические опилки.
Отдельной группой стоят преобразователи ржавчины — составы, которые наносят на уже затронутые коррозией конструкции. Они восстанавливают железо из окислов и предотвращают повторную коррозию. Преобразователи делятся на следующие виды:
- Грунты. Наносятся на зачищенную поверхность, обладают высокой адгезией. Содержат в своем составе ингибирующие вещества, позволяют экономить финишную краску.
- Стабилизаторы. Преобразуют оксиды железа в другие вещества.
- Преобразователи оксидов железа в соли.
- Масла и смолы, обволакивающие частички ржавчины и нейтрализующие ее.


Грунт-преобразователь ржавчины
При выборе грунта и краски лучше брать их от одного производителя. Так вы избежите проблем совместимости лакокрасочных материалов.
Защитные краски по металлу
По температурному режиму эксплуатации краски делятся на две большие группы:
- обычные, используемые при температурах до 80 °С;
- термостойкие.
По типу связующей основы краски бывают:
- алкидные;
- акриловые;
- эпоксидные.
Лакокрасочные покрытия по металлу имеют следующие достоинства:
- качественная защита поверхности от коррозии;
- легкость нанесения;
- быстрота высыхания;
- много разных цветов;
- долгий срок службы.
Большой популярностью пользуются молотковые эмали, не только защищающие метал, но и создающие эстетичный внешний вид. Для обработки металла распространена также краска-серебрянка. В ее состав добавлена алюминиевая пудра. Защита металла происходит за счет образования тонкой пленки окиси алюминия.


Краска-серебрянка
Эпоксидные смеси из двух компонентов отличаются исключительной прочностью покрытия и применяются для узлов, подверженных высоким нагрузкам.
Защита металла в бытовых условиях
Чтобы надежно защитить металлические изделия от коррозии, следует выполнить следующую последовательность действий:
- очистить поверхность от ржавчины и старой краски с помощью проволочной щетки или абразивной бумаги;
- обезжирить поверхность;
- сразу же нанести слой грунта;
- после высыхания грунта нанести два слоя основной краски.
При работе следует использовать средства индивидуальной защиты:
- перчатки;
- респиратор;
- очки или прозрачный щиток.
Способы защиты металлов от коррозии постоянно совершенствуются учеными и инженерами.
Методы противостояния коррозионным процессам
Основные методы, применяемые для противодействия коррозии, приведены ниже:
- повышение способности материалов противостоять окислению за счет изменения его химического состава;
- изоляция защищаемой поверхности от контакта с активными средами;
- снижение активности окружающей изделие среды;
- электрохимические.
Первые две группы способов применяются во время изготовления конструкции, а вторые – во время эксплуатации.
Методы повышения сопротивляемости
В состав сплава добавляют элементы, повышающие его коррозионную устойчивость. Такие стали называют нержавеющими. Они не требуют дополнительных покрытий и отличаются эстетичным внешним видом. В качестве добавок применяют никель, хром, медь, марганец, кобальт в определенных пропорциях.


Нержавеющая сталь AISI 304
Стойкость материалов к ржавлению повышают также, удаляя их состава ускоряющие коррозию компоненты, как, например, кислород и серу — из стальных сплавов, а железо – из магниевых и алюминиевых.
Снижение агрессивности внешней среды и электрохимическая защита
С целью подавления процессов окисления во внешнюю среду добавляют особые составы — ингибиторы. Они замедляют химические реакции в десятки и сотни раз.
Электрохимические способы сводятся к изменению электрохимического потенциала материала путем пропускания электрического тока. В результате коррозионные процессы сильно замедляются или даже вовсе прекращаются.
Пленочная защита
Защитная пленка препятствует доступу молекул активных веществ к молекулам металла и таким образом предотвращают коррозионные явления.
Пленки образуются из лакокрасочных материалов, пластмассы и смолы. Лакокрасочные покрытия недороги и удобны в нанесении. Ими покрывают изделие в несколько слоев. Под краску наносят слой грунта, улучшающего сцепление с поверхностью и позволяющего экономить более дорогую краску. Служат такие покрытия от 5 до 10 лет. В качестве грунта иногда применяют смесь фосфатов марганца и железа.
Защитные покрытия создают также из тонких слоев других металлов: цинка, хрома, никеля. Их наносят гальваническим способом.
Покрытие металлом с более высоким электрохимическим потенциалом, чем у основного материала, называется анодным. Оно продолжает защищать основной материал, отвлекая активные окислители на себя, даже в случае частичного разрушения. Покрытия с более низким потенциалом называют катодными. В случае нарушения такого покрытия оно ускоряет коррозию за счет электрохимических процессов.
Металлическое покрытие также можно наносить также методом распыления в струе плазмы.
Применяется также и совместный прокат нагретых до температуры пластичности листов основного и защищающего металла. Под давлением происходит взаимная диффузия молекул элементов в кристаллические решетки друг друга и образование биметаллического материала. Этот метод называют плакированием.
Металлические защитные покрытия (анодные, катодные). — Студопедия
Неметаллические защитные покрытия. Электрохимические методы защиты от коррозии.
Методы защиты от коррозии можно объединить в следующие группы:
1) нанесение защитных покрытий и пленок;
2) изменение электрохимического потенциала защищаемого материала по отношению к среде на границе фаз;
3) модификация коррозионной среды.
Борьба с коррозией с применением защитных покрытий является наиболее распространенным способом. В качестве защитных применяют металлические и неметаллические покрытия.
Металлические покрытия могут быть выполнены из металла более или менее благородного, чем подложка. В связи с этим они делятся на две группы: катодные и анодные покрытия.
К катодным покрытиям относятся те покрытия, электрохимический потенциал которых в данных условиях больший, чем у защищаемого металла. На алюминий почти всегда наносят катодные покрытия. Покрытия из благородных металлов на стали имеют такой же характер. Катодные покрытия защищают металл только благодаря его изоляции от атакующей среды. Поэтому свою роль они выполняют только при наличии полной сплошности. Если в катодном покрытии образуется щель, то в условиях коррозии она становится катодом, а открытая часть защищаемого металла – анодным элементом. Анодная поверхность при этом значительно меньше, чем катодная. Электрохимическое разрушение металла концентрируется на небольшой поверхности. Учитывая опасности, кроющиеся в возможных несплошностях катодных покрытий, их делают сравнительно большой толщины.
Анодные покрытия – это покрытия, выполненные из металла, у которого электродный потенциал меньше, чем у защищаемого металла. Для железа, работающего в малокислых или нейтральных растворах, анодными покрытиями являются цинк, алюминий. Защитные свойства анодных покрытий состоят не только в механической изоляции металла от коррозионной среды. Они заключаются еще и в электрохимическом воздействии. В случае нарушения покрытия и образования коррозионного элемента, защищаемый металл, являющийся катодом, не разрушается. Небольшие несплошности в анодных покрытиях не опасны.
Металлические покрытия наносят электроосаждением, погружением в расплавленные металлы, металлизацией напылением, химическим осаждением солей, диффузией и т. д. В последнее время все большее распространение получает нанесение покрытий в вакууме.
Неметаллические покрытия применяются в случае возникновения химической реакции металла в соответствующих средах. К ним, в частности, относят оксидные алюминиевые покрытия, полученные в ходе специального электролитического процесса. Фосфатные покрытия применяются в большинстве случаев с дополнительными защитными средами, как, например, краски, лаки и т. п. Фосфатирование стали состоит в погружении изделия в разбавленный раствор фосфорной кислоты и кислых фосфатов цинка или магния. В результате реакции образуется нерастворимый фосфат железа, который в ходе процесса плотно покрывает поверхность металла. К этой же группе относят керамические покрытия и стекловидные эмали. Эти покрытия достаточно стойки к воздействию минеральных и органических кислот. Их недостатком является повышенная хрупкость и низкая стойкость в условиях резких перепадов температуры.
Одним из самых популярных способов защиты металла от коррозии является нанесение неметаллических составов. Это может быть пластик, керамика, каучук, битум, полиуретан, лакокрасочные составы и многое другое. Причем последние представляют собой наиболее широкий ассортимент и могут применяться в зависимости от условий среды, в которых будет использоваться изделие. Так выделяют лакокрасочные покрытия, устойчивые к действиям воды, атмосферы, химическим растворам и т. д.
К органическим покрытиям относятся разнообразные лакокрасочные материалы.
Знание механизма коррозии позволило создать методы коррозионной защиты путем наложения на металл такого потенциала, при котором он становится термодинамически устойчивым. К таким методам относятся катодная защита и уменьшение агрессивности среды, окружающей металлоконструкцию.
Катодная защита состоит в присоединении к защищаемой конструкции анода-протектора с более отрицательным электрохимическим потенциалом. Протектор (лат. protector – покровитель, защитник) и служит таким анодом, препятствующим разрушению защищаемого сплава; сам протектор при коррозии постепенно разрушается.
Протектором может являться любой металл, имеющий по отношению к данному сплаву более отрицательный потенциал. Однако разница в потенциалах не должна быть слишком большой, чтобы при электрохимическом процессе не происходило быстрого разрушения протектора.
Протекторы представляют собой обычно небольшие пластинки, присоединяемые к защищаемой детали заклепками или болтами. Катодную или протекторную защиту широко применяют при защите от морской и подземной коррозии металлоконструкций, коммуникаций, трубопроводов, сосудов и т. д. В качестве анодов-протекторов для защиты стальных изделий обычно применяют сплавы магния или цинка. Защита может также осуществляться присоединением защищаемого металла к отрицательному полюсу постоянного тока.
Для уменьшения агрессивности окружающей среды в нее вводят добавки, называемые ингибиторами коррозии, которые или способствуют пассивации металла, или значительно снижают скорость его коррозии. Условием использования ингибиторов является эксплуатация изделия в замкнутой среде постоянного состава.
Различают анодные и катодные ингибиторы. В качестве анодных ингибиторов коррозии используют различные вещества, образующие нерастворимые соединения на анодных участках. Одним из таких пассиваторов является хромпик К2Сr207, вводимый в количестве 2 – 3 г/л в раствор охлаждающей жидкости.
Катодные ингибиторы тормозят катодный процесс. К их числу относятся различные травильные присадки, добавляемые в количестве 1 – 2 % в кислоты для снятия окалины без разрушения основного металла.
Летучие ингибиторы, такие как нитрат натрия NaNO2, применяют для пропитки бумаги, в которую заворачивают детали, подлежащие хранению или транспортировке. Испаряясь, они насыщают окружающее детали пространство, создавая защитную газовую среду. Летучие ингибиторы отличаются высокой эффективностью. Стальные изделия, завернутые в бумагу, обработанную NaNO2, в условиях относительной влажности 85 % не ржавеют в течение 5 лет. Преимуществом летучих ингибиторов является отказ от применения защитных покрытий, удобство расконсервации и постоянная готовность деталей к немедленному использованию без дополнительной обработки.
Суть электрохимической защиты
К готовому металлическому изделию извне подключается постоянный ток (источник постоянного тока или протектор). Электрический ток на поверхности защищаемого изделия создает катодную поляризацию электродов микрогальванических пар. Результатом этого является то, что анодные участки на поверхности металла стают катодными. А вследствии воздействия коррозионной среды идет разрушение не металла конструкции, а анода.
| На главную | База 1 | База 2 | База 3 |
| Поиск по реквизитамПоиск по номеру документаПоиск по названию документаПоиск по тексту документа |
| Искать все виды документовДокументы неопределённого видаISOАвиационные правилаАльбомАпелляционное определениеАТКАТК-РЭАТПЭАТРВИВМРВМУВНВНиРВНКРВНМДВНПВНПБВНТМ/МЧМ СССРВНТПВНТП/МПСВНЭВОМВПНРМВППБВРДВРДСВременное положениеВременное руководствоВременные методические рекомендацииВременные нормативыВременные рекомендацииВременные указанияВременный порядокВрТЕРВрТЕРрВрТЭСНВрТЭСНрВСНВСН АСВСН ВКВСН-АПКВСПВСТПВТУВТУ МММПВТУ НКММПВУП СНЭВУППВУТПВыпускГКИНПГКИНП (ОНТА)ГНГОСТГОСТ CEN/TRГОСТ CISPRГОСТ ENГОСТ EN ISOГОСТ EN/TSГОСТ IECГОСТ IEC/PASГОСТ IEC/TRГОСТ IEC/TSГОСТ ISOГОСТ ISO GuideГОСТ ISO/DISГОСТ ISO/HL7ГОСТ ISO/IECГОСТ ISO/IEC GuideГОСТ ISO/TRГОСТ ISO/TSГОСТ OIML RГОСТ ЕНГОСТ ИСОГОСТ ИСО/МЭКГОСТ ИСО/ТОГОСТ ИСО/ТСГОСТ МЭКГОСТ РГОСТ Р ЕНГОСТ Р ЕН ИСОГОСТ Р ИСОГОСТ Р ИСО/HL7ГОСТ Р ИСО/АСТМГОСТ Р ИСО/МЭКГОСТ Р ИСО/МЭК МФСГОСТ Р ИСО/МЭК ТОГОСТ Р ИСО/ТОГОСТ Р ИСО/ТСГОСТ Р ИСО/ТУГОСТ Р МЭКГОСТ Р МЭК/ТОГОСТ Р МЭК/ТСГОСТ ЭД1ГСНГСНрГСССДГЭСНГЭСНмГЭСНмрГЭСНмтГЭСНпГЭСНПиТЕРГЭСНПиТЕРрГЭСНрГЭСНсДИДиОРДирективное письмоДоговорДополнение к ВСНДополнение к РНиПДСЕКЕНВиРЕНВиР-ПЕНиРЕСДЗемЕТКСЖНМЗаключениеЗаконЗаконопроектЗональный типовой проектИИБТВИДИКИМИНИнструктивное письмоИнструкцияИнструкция НСАМИнформационно-методическое письмоИнформационно-технический сборникИнформационное письмоИнформацияИОТИРИСОИСО/TRИТНИТОсИТПИТСИЭСНИЭСНиЕР Республика КарелияККарта трудового процессаКарта-нарядКаталогКаталог-справочникККТКОКодексКОТКПОКСИКТКТПММ-МВИМВИМВНМВРМГСНМДМДКМДСМеждународные стандартыМетодикаМетодика НСАММетодические рекомендацииМетодические рекомендации к СПМетодические указанияМетодический документМетодическое пособиеМетодическое руководствоМИМИ БГЕИМИ УЯВИМИГКМММНМОДНМонтажные чертежиМос МУМосМРМосСанПинМППБМРМРДСМРОМРРМРТУМСанПиНМСНМСПМТМУМУ ОТ РММУКМЭКННАС ГАНБ ЖТНВННГЭАНДНДПНиТУНКНормыНормы времениНПНПБНПРМНРНРБНСПНТПНТП АПКНТП ЭППНТПДНТПСНТСНЦКРНЦСОДМОДНОЕРЖОЕРЖкрОЕРЖмОЕРЖмрОЕРЖпОЕРЖрОКОМТРМОНОНДОНКОНТПОПВОПКП АЭСОПНРМСОРДОСГиСППиНОСНОСН-АПКОСПОССПЖОССЦЖОСТОСТ 1ОСТ 2ОСТ 34ОСТ 4ОСТ 5ОСТ ВКСОСТ КЗ СНКОСТ НКЗагОСТ НКЛесОСТ НКМОСТ НКММПОСТ НКППОСТ НКПП и НКВТОСТ НКСМОСТ НКТПОСТ5ОСТНОСЭМЖОТРОТТПП ССФЖТПБПБПРВПБЭ НППБЯПВ НППВКМПВСРПГВУПереченьПиН АЭПисьмоПМГПНАЭПНД ФПНД Ф СБПНД Ф ТПНСТПОПоложениеПорядокПособиеПособие в развитие СНиППособие к ВНТППособие к ВСНПособие к МГСНПособие к МРПособие к РДПособие к РТМПособие к СНПособие к СНиППособие к СППособие к СТОПособие по применению СППостановлениеПОТ РПОЭСНрППБППБ-АСППБ-СППБВППБОППРПРПР РСКПР СМНПравилаПрактическое пособие к СППРБ АСПрейскурантПриказПротоколПСРр Калининградской областиПТБПТЭПУГПУЭПЦСНПЭУРР ГазпромР НОПРИЗР НОСТРОЙР НОСТРОЙ/НОПР РСКР СМНР-НП СРО ССКРазъяснениеРаспоряжениеРАФРБРГРДРД БГЕИРД БТРД ГМРД НИИКраностроенияРД РОСЭКРД РСКРД РТМРД СМАРД СМНРД ЭОРД-АПКРДИРДМРДМУРДПРДСРДТПРегламентРекомендацииРекомендацияРешениеРешение коллегииРКРМРМГРМДРМКРНДРНиПРПРРТОП ТЭРС ГАРСНРСТ РСФСРРСТ РСФСР ЭД1РТРТМРТПРУРуководствоРУЭСТОП ГАРЭГА РФРЭСНрСАСанитарные нормыСанитарные правилаСанПиНСборникСборник НТД к СНиПСборники ПВРСборники РСН МОСборники РСН ПНРСборники РСН ССРСборники ценСБЦПСДАСДАЭСДОССерияСЗКСНСН-РФСНиПСНиРСНККСНОРСНПСОСоглашениеСПСП АССП АЭССправочникСправочное пособие к ВСНСправочное пособие к СНиПСправочное пособие к СПСправочное пособие к ТЕРСправочное пособие к ТЕРрСРПССНССЦСТ ССФЖТСТ СЭВСТ ЦКБАСТ-НП СРОСТАСТКСТМСТНСТН ЦЭСТОСТО 030 НОСТРОЙСТО АСЧМСТО БДПСТО ВНИИСТСТО ГазпромСТО Газпром РДСТО ГГИСТО ГУ ГГИСТО ДД ХМАОСТО ДОКТОР БЕТОНСТО МАДИСТО МВИСТО МИСТО НААГСТО НАКССТО НКССТО НОПСТО НОСТРОЙСТО НОСТРОЙ/НОПСТО РЖДСТО РосГеоСТО РОСТЕХЭКСПЕРТИЗАСТО САСТО СМКСТО ФЦССТО ЦКТИСТО-ГК «Трансстрой»СТО-НСОПБСТПСТП ВНИИГСТП НИИЭССтП РМПСУПСССУРСУСНСЦНПРТВТЕТелеграммаТелетайпограммаТематическая подборкаТЕРТЕР Алтайский крайТЕР Белгородская областьТЕР Калининградской областиТЕР Карачаево-Черкесская РеспубликаТЕР Краснодарского краяТЕР Мурманская областьТЕР Новосибирской областиТЕР Орловской областиТЕР Республика ДагестанТЕР Республика КарелияТЕР Ростовской областиТЕР Самарской областиТЕР Смоленской обл.ТЕР Ямало-Ненецкий автономный округТЕР Ярославской областиТЕРмТЕРм Алтайский крайТЕРм Белгородская областьТЕРм Воронежской областиТЕРм Калининградской областиТЕРм Карачаево-Черкесская РеспубликаТЕРм Мурманская областьТЕРм Республика ДагестанТЕРм Республика КарелияТЕРм Ямало-Ненецкий автономный округТЕРмрТЕРмр Алтайский крайТЕРмр Белгородская областьТЕРмр Карачаево-Черкесская РеспубликаТЕРмр Краснодарского краяТЕРмр Республика ДагестанТЕРмр Республика КарелияТЕРмр Ямало-Ненецкий автономный округТЕРпТЕРп Алтайский крайТЕРп Белгородская областьТЕРп Калининградской областиТЕРп Карачаево-Черкесская РеспубликаТЕРп Краснодарского краяТЕРп Республика КарелияТЕРп Ямало-Ненецкий автономный округТЕРп Ярославской областиТЕРрТЕРр Алтайский крайТЕРр Белгородская областьТЕРр Калининградской областиТЕРр Карачаево-Черкесская РеспубликаТЕРр Краснодарского краяТЕРр Новосибирской областиТЕРр Омской областиТЕРр Орловской областиТЕРр Республика ДагестанТЕРр Республика КарелияТЕРр Ростовской областиТЕРр Рязанской областиТЕРр Самарской областиТЕРр Смоленской областиТЕРр Удмуртской РеспубликиТЕРр Ульяновской областиТЕРр Ямало-Ненецкий автономный округТЕРррТЕРрр Ямало-Ненецкий автономный округТЕРс Ямало-Ненецкий автономный округТЕРтр Ямало-Ненецкий автономный округТехнический каталогТехнический регламентТехнический регламент Таможенного союзаТехнический циркулярТехнологическая инструкцияТехнологическая картаТехнологические картыТехнологический регламентТИТИ РТИ РОТиповая инструкцияТиповая технологическая инструкцияТиповое положениеТиповой проектТиповые конструкцииТиповые материалы для проектированияТиповые проектные решенияТКТКБЯТМД Санкт-ПетербургТНПБТОИТОИ-РДТПТПРТРТР АВОКТР ЕАЭСТР ТСТРДТСНТСН МУТСН ПМСТСН РКТСН ЭКТСН ЭОТСНэ и ТЕРэТССЦТССЦ Алтайский крайТССЦ Белгородская областьТССЦ Воронежской областиТССЦ Карачаево-Черкесская РеспубликаТССЦ Ямало-Ненецкий автономный округТССЦпгТССЦпг Белгородская областьТСЦТСЦ Белгородская областьТСЦ Краснодарского краяТСЦ Орловской областиТСЦ Республика ДагестанТСЦ Республика КарелияТСЦ Ростовской областиТСЦ Ульяновской областиТСЦмТСЦО Ямало-Ненецкий автономный округТСЦп Калининградской областиТСЦПГ Ямало-Ненецкий автономный округТСЦэ Калининградской областиТСЭМТСЭМ Алтайский крайТСЭМ Белгородская областьТСЭМ Карачаево-Черкесская РеспубликаТСЭМ Ямало-Ненецкий автономный округТТТТКТТПТУТУ-газТУКТЭСНиЕР Воронежской областиТЭСНиЕРм Воронежской областиТЭСНиЕРрТЭСНиТЕРэУУ-СТУказУказаниеУказанияУКНУНУОУРврУРкрУРррУРСНУСНУТП БГЕИФАПФедеральный законФедеральный стандарт оценкиФЕРФЕРмФЕРмрФЕРпФЕРрФормаФорма ИГАСНФРФСНФССЦФССЦпгФСЭМФТС ЖТЦВЦенникЦИРВЦиркулярЦПИШифрЭксплуатационный циркулярЭРД |
| Показать все найденные Показать действующие Показать частично действующие Показать не действующие Показать проекты Показать документы с неизвестным статусом |
| Упорядочить по номеру документаУпорядочить по дате введения |
Методы защиты подводных свай от коррозии
Защита подводных свай от коррозии имеет важное значение в случае стальных свай. Когда стальные сваи используются в морской воде, она вступает в химическую реакцию с образованием анодов и катодов, в результате чего возникает электрический ток, что приводит к коррозии анодных участков свай.
Химически активные поверхности подводных стальных свай действуют как аноды, а менее химически активные поверхности действуют как катоды.
Что такое коррозия свай?
Коррозия может быть определена как ухудшение состояния металла из-за реакции с водой и атмосферным воздухом или окисление металлов, катализируемое химической реакцией с окружающей средой.
Что такое подводные сваи?
Сваи — это элемент каркаса здания, используемый для передачи нагрузок от надстройки на землю.
При возведении сооружения на воде сваи забиваются в воде в подводные слои. Поскольку сваи всегда находятся внутри воды, они подвержены коррозии. Устранить эту проблему коррозии очень сложно, но ее можно контролировать, используя меры защиты от коррозии.
Зоны коррозии подводных стальных свай
Сваи, забиваемые в толщу воды, подвергаются коррозии в нескольких зонах из-за различного контакта с водой.Эти области удобно разделить на четыре зоны, каждая из которых имеет характерную скорость коррозии, как показано на рисунке ниже.
Методы защиты от коррозии для подводных свай
Защитные покрытия для подводных свай
Коррозия в сваях образуется при контакте поверхности сваи с водой. Чтобы сваи не контактировали с водой, сваю необходимо покрыть непористым антикоррозионным материалом.
Для подводных свай используются следующие типы покрытий:
Грунтовки на основе силикатов неорганического цинка
Стальные конструкции, которые находятся ниже зоны заплеска, всегда погружены в воду, обычно не покрываются какими-либо катодными защитными слоями по очевидным причинам.
Существует множество типов пигментированных антикоррозионных грунтовок, в которых лучше всего подходит неорганический силикат цинка. Лучшая часть этого заключается в том, что он задерживает расползание ржавчины или подрезание покрытия, окружающего область повреждения, и ограничивает коррозию до точки повреждения.
Высокоструйные эпоксидные покрытия
Эти эпоксидные покрытия более устойчивы к истиранию и химическим воздействиям, чем грунтовки и покрытия. Это потому, что они защищают не только металл, но и цинковые грунтовки от вредных факторов.
Еще он имеет недостаток — плохую устойчивость к солнечному свету и мелу. При контакте с этими факторами они быстро тускнеют, что приводит к эрозии покрытия, что, в свою очередь, снижает барьерную защиту системы.
Алифатические полиуретановые покрытия
Полиуретан на самом деле не является антикоррозийным или коррозионным барьером, но обеспечивает оптимальную стойкость к УФ-излучению и высокую степень гибкости и химической стойкости.
Они также помогают сохранить косметический блеск и цвет материала. Они обеспечивают высокий уровень защиты системы покрытия.
Цинковые эпоксидные грунтовки
In представляет собой смесь неорганической цинкосиликатной грунтовки и высокоструктурированного эпоксидного покрытия. Обеспечивает высокий уровень обслуживания и более терпимые погодные условия. Кроме того, он наиболее эффективен для ухода за поврежденной зоной и поломки системы покрытия.
Нескользящие покрытия для настила
Они наносятся на очень толстые пленки и обычно без грунтовки с высоким содержанием цинка.Покрытия, специально разработанные с противоскользящими свойствами, обычно содержат очень ровные заполнители для преувеличенного профиля.
Они наносятся на очень толстые пленки и обычно без грунтовки с высоким содержанием цинка. Когда требуются грунтовки, они обычно бывают эпоксидными.
Катодная защита подводных свай
Катодная защита — это широко используемый метод борьбы с коррозией свай. Катодная защита — это процесс использования электрохимических реакций для предотвращения коррозии стали.Он широко используется и принят, поскольку предотвращает коррозию стали, находящейся в воде.
Теоретически и практически реализовать систему катодной защиты достаточно просто. Предполагая, что у вас уже есть коррозионная сталь в морской воде, все, что вам нужно, — это анод, источник питания и инженерный талант. Между анодом, сталью (катодом), источником питания и электролитом (морская вода) установлена защитная цепь.
Это очень простой процесс установки катодной защиты для подводных свай.При коррозии стали анод с источником питания вставляется в воду рядом со сталью. Установка или доставка анода осуществляется разными способами в зависимости от различных факторов. Виды поставки анода,
Анод сваевой
Этот тип метода доставки анода используется, когда анод может быть прикреплен к катоду или сваям напрямую. Анод, установленный на свае, разработан для эффективного распределения тока внутри и вокруг сваи, когда возникает сложность размещения анода в свае в удаленных местах.
Анод с плоской задней свайной установкой был разработан специально для H-образных свай, и его также можно настроить для установки на шпунт.
Анод сваевой
Выдвижное крепление
Этот тип системы подачи анода используется, когда анод необходимо периодически заменять новым. Когда катодная защита требуется только время от времени, но не постоянно, используется этот тип системы, так что анод можно легко заменить.
Выдвижная опора
Анод салазок
Анодымогут быть спроектированы для работы как в морской воде, так и в грязи. Аноды, установленные на морском дне, обычно обеспечивают наилучшую защиту морской конструкции.
Регулируя высоту бетонных салазок, сетчатые анодные салазки также могут быть разработаны для работы вне грязи. Салазки Post Tension были разработаны для защиты анода от грязи при отдыхе в илистом и мягком морском дне.
Преимуществом этого типа санок является их низкий профиль, что ограничивает возможность повреждения якорем рыболовных сетей и т. Д.
Анод салазок
Применение композитов из стеклопластика для защиты подводных свай от коррозии
Использование FRP заключается в том, что он просто смешивается с влажным бетоном, что делает экономичным проведение ремонта частей основания.
Обычно ремонт этих деталей требует расширения для установки новых стяжек.Но при использовании FRP полностью корродированная часть элемента осторожно удаляется, и применяется этот бетон, индуцированный FRP, который обеспечивает потерянную способность к растяжению, а также обеспечивает боковую поддержку стали.
Поскольку стеклопластик наносится на бетон, распространение коррозии на другие сваи может быть защищено и в то же время защита от УФ-покрытия на обертке нужного цвета. Эстетика ремонта FRP — одно из его неоспоримых преимуществ.
Обертка FRP для корродированных мостовых свай
.Анодная защита от коррозии — Большая Химическая Энциклопедия
Риггс О.Л. и Локк С.Е. Теория и практика анодной защиты в предотвращении коррозии, 1981 год (пленум в Нью-Йорке) … [Стр. 2739]Аноды. Свинцово-сурьмянистые (6… 10 мас.%) Сплавы, содержащие 0,5… 1,0 мас.% Мышьяка, широко используются в качестве анодов в процессах электрохимического извлечения меди, никеля и хрома и в процессах нанесения покрытий на металл. Свинцово-сурьмянистые аноды обладают высокой прочностью и при использовании образуют устойчивый к коррозии защитный слой из диоксида свинца.Свинцово-сурьмянистые аноды устойчивы к пассивации при частом прерывании тока. [Стр.57]
Пластинчатые и рамные охладители с пластинами HasteUoy C-276 успешно используются. Пластинчатые охладители с анодной защитой доступны в виде пластинчатых охладителей с пластинами, сваренными вместе для минимизации уплотнения. Еще одна перспективная разработка — внедрение пластинчатых кулеров из HasteUoy D205 (105). Этот автозавод имеет значительно лучшую коррозионную стойкость к концентрированной серной кислоте при более высоких температурах, чем C-276.Из-за малого зазора между пластинами охлаждающая вода для пластинчатых охладителей должна быть относительно чистой. [Стр.187]
Анодные ингибиторы. Пассивирующие или анодные ингибиторы приводят к значительному положительному сдвигу в потенциале коррозии металла. Существует два класса анодных ингибиторов, которые используются для металлов и сплавов, где анодный сдвиг потенциала способствует пассивации, то есть анодной защите. К классу fkst относятся окисляющие анионы, которые могут пассивировать металл в отсутствие кислорода.Хромат — классический пример анодного ингибитора окисления для пассивации сталей. [Стр.282]
Усталостную долговечность можно немного увеличить за счет анодной защиты или пассивации. В кислотах даже пассивные нержавеющие хромоникелевые стали подвержены коррозионной усталости [104]. Сопротивление может возникнуть, если пассивная пленка сама по себе обладает усталостной прочностью (например, в нейтральной воде [105]). [Pg.70]
Основы этого метода защиты рассматриваются в разделе 2.3 и проиллюстрированы на рис. 2-15.Защита от коррозии для стабильно-пассивного состояния не требуется, поскольку материал достаточно устойчив к коррозии для условий свободной коррозии. Если активация происходит из-за временного нарушения, материал немедленно возвращается в стабильное пассивное состояние. Это не относится к метастабильному пассивному состоянию. В этом случае необходима анодная защита для возврата в пассивное состояние. Анодная защита также эффективна в нестабильном пассивном состоянии материала, но она должна быть постоянно включена, в отличие от метастабильного пассивного состояния.[Pg.474]
Особая проблема возникает при анодной защите газового пространства, потому что анодная защита здесь не действует и существует опасность активной коррозии. Таким образом, эти районы, находящиеся под угрозой, должны быть приняты во внимание при проектировании химических … [Pg.477]
При производстве серной кислоты, включающем рекуперацию тепла и регенерацию отработанной серной кислоты, можно иметь дело с кислотами различной концентрации при высоких температурах. . Например, в охладителях серной кислоты наблюдается коррозионное повреждение, что серьезно снижает эксплуатационную готовность таких установок.Использование анодной защиты может предотвратить такое повреждение. [Pg.478]
Углеродистые стали можно анодно защитить в определенных солевых растворах. В основном это продукты производства удобрений, такие как Nh4, Nh5NO3 и мочевина. Анодная защита действует до 90 ° C [26]. Коррозия в газовом пространстве подавляется контролем pH и поддержанием избытка Nh4. [Pg.480]
Коррозия под напряжением может возникнуть в углеродистых и низколегированных сталях при наличии критических условий температуры, концентрации и потенциала в горячих щелочных растворах (см. Раздел 2.3.3). Диапазон критических потенциалов коррозии под напряжением показан на рис. 2-18. Этот диапазон потенциалов соответствует переходу активный / пассивный. Теоретически возможна анодная защита, а также катодная защита (см. Раздел 2.4), однако в активном состоянии происходит заметное незначительное растворение стали из-за образования ионов FeO. Поэтому для защиты водоэлектролизной установки, работающей с раствором едкого калия, от коррозии под напряжением был выбран метод анодной защиты [30].Ток защиты обеспечивался электролитическими ячейками завода. [Pg.481]
Шесть испарителей каустической соды были анодно защищены от коррозии под напряжением в алюминиевой промышленности Германии в 1965 году [27]. Каждый испаритель имел площадь внутренней поверхности 2400 м 2. Трансформатор-выпрямитель имел мощность 300 АДж 5 В и много лет работал с перебоями. Автоматическое включение тока защиты происходило только в случае необходимости, когда достигалось падение потенциала… [Pg.481]
Безопасность, доступность и мощность производственных предприятий предопределяются качеством материалов, а меры защиты от коррозии в основных областях являются основными соображениями при первоначальном планировании. Даже сегодня считается, что повреждение оборудования и резервуаров неизбежно, и поврежденные компоненты регулярно заменяются. Путем проведения анализа повреждений, который указывает путь к знаниям о предотвращении повреждений, можно значительно увеличить доступность и продолжительность жизни растений.В особенности это касается использования анодной защиты. [Pg.485]
Использование коррозионно-стойких материалов и применение мер защиты от коррозии во многих случаях является причиной того, что промышленные предприятия и сооружения вообще можно строить. В особенности это касается трубопроводной техники. Без катодной защиты и без подходящего покрытия в качестве предварительного условия эффективности катодной защиты транспортировка нефти и газа на большие расстояния под высоким давлением была бы невозможна.Кроме того, анодная защита была единственной защитной мерой, делавшей возможной безопасную работу испарителей щелочного раствора (см. Раздел 21.5). [Pg.489]
Спирально-пластинчатые теплообменники изготавливаются из любого материала, который поддается холодной обработке и сварке. Обычно используемые материалы включают углеродистую сталь, нержавеющую сталь, никель и никелевые сплавы, титан, сплавы Hastelloy и медные сплавы. Иногда применяются покрытия из обожженной фенольной смолы. Электроды также могут быть намотаны в сборку для анодной защиты поверхностей от коррозии.[Pg.36]
Анодная защита — метод уменьшения коррозии металлической поверхности путем пропускания к ней достаточного анодного тока, чтобы его электродный потенциал перешел в пассивное состояние. [Pg.46]
Коррозионная стойкость нелегированного титана в соляной или серной кислоте может быть значительно увеличена за счет анодной защиты, которая поддерживает оксидную пленку, так что коррозия будет незначительной даже в сильно восстановительных условиях. [Стр.96]
Для защиты оборудования из нержавеющей стали от хлоридного коррозионного растрескивания под напряжением путем срабатывания системы анодной защиты, когда измеренный потенциал падает до значения, близкого к известному как соответствующее условиям коррозии под напряжением.[Pg.33]
Для активации системы анодной защиты охладителей из нержавеющей стали, охлаждающих горячую концентрированную серную кислоту, когда потенциал приближается к активной коррозии. [Стр.33]
Прежде чем рассматривать принципы этого метода, полезно различать анодную защиту и катодную защиту (когда последняя создается внешним ЭДС). Оба эти метода, которые можно использовать для уменьшения коррозии металлов при контакте с электролитами, зависят от электрохимических механизмов, возникающих в результате изменения потенциала металла.Соответствующая диаграмма потенциал-pH для системы Fe-h30 (раздел 1.4) показывает величину и направление изменений потенциала железа, погруженного в воду (pH около 7), необходимых для того, чтобы сделать его либо пассивным, либо невосприимчивым в первом случае. Стабильность металла зависит от образования защитной пленки из оксида металла (пассивация), тогда как в последнем случае сам металл является термодинамически стабильным, и таким образом предотвращается выход ионов металла из решетки в раствор. [Стр.261]
Еще одно отличие состоит в том, что при анодной защите скорость коррозии (плотность тока пассивации) всегда будет конечной, тогда как в идеале металл с полностью катодной защитой вообще не должен подвергаться коррозии. Повышение потенциала … [Pg.261]
Большинство применений анодной защиты связаны с производством, хранением и транспортировкой серной кислоты, которой во всем мире производится больше, чем любого другого химического вещества. Олеум представляет собой 100% серную кислоту, содержащую дополнительно растворенный триоксид серы.Скорость коррозии стали в 77–100% -ной серной кислоте составляет 500–1 000 мкм при 24 ° C и до 5 000 мкм при 100 ° C, что указывает на необходимость дополнительной защиты. [Pg.269]
.
Анодная защита от коррозии — Большая Химическая Энциклопедия
Титан потенциально может использоваться в опреснительных установках для преобразования морской воды в пресную. Этот металл имеет отличную стойкость к морской воде и используется для изготовления гребных валов, такелажа и других частей судов, подверженных воздействию соленой воды. Титановый анод, покрытый платиной, использовался для обеспечения катодной защиты от коррозии под воздействием соленой воды. [Pg.76]Процесс электролизной защиты с использованием алюминиевых анодов наложенного тока позволяет защитить от коррозии черные металлы без покрытия и горячеоцинкованные материалы в бытовых установках.Если в резервуарах для воды установлены алюминиевые аноды с подаваемым током, трубопровод защищен пленкой, не влияющей на пригодность воды для питья. На отечественных оцинкованных стальных трубах происходит заметное замедление катодной парциальной реакции [15]. Электролитическая обработка изменяет электролитические характеристики воды, а также внутреннюю катодную защиту резервуара и его вставок (например, нагревательных элементов). Защита труб основана на коллоидных химических процессах и применяется только к новым установкам, а не к старым, уже подвергшимся коррозии.[Pg.456]
Спирально-пластинчатые теплообменники изготавливаются из любого материала, который поддается холодной обработке и сварке. Обычно используемые материалы включают углеродистую сталь, нержавеющую сталь, никель и никелевые сплавы, титан, сплавы Hastelloy и медные сплавы. Иногда применяются покрытия из обожженной фенольной смолы. Электроды также могут быть намотаны в сборку для анодной защиты поверхностей от коррозии. [Стр.36]
Для защиты оборудования из нержавеющей стали от хлоридного коррозионного растрескивания под напряжением путем срабатывания системы анодной защиты, когда измеренный потенциал падает до значения, близкого к известному как соответствующее условиям коррозии под напряжением.[Стр.33]
Прежде чем рассматривать принципы этого метода, полезно различать анодную защиту и катодную защиту (когда последняя создается внешним ЭДС). Оба эти метода, которые можно использовать для уменьшения коррозии металлов при контакте с электролитами, зависят от электрохимических механизмов, возникающих в результате изменения потенциала металла. Соответствующая диаграмма потенциал-pH для системы Fe-h30 (раздел 1.4) показывает величину и направление изменений потенциала железа, погруженного в воду (pH около 7), необходимых для того, чтобы сделать его либо пассивным, либо невосприимчивым в первом случае. Стабильность металла зависит от образования защитной пленки из оксида металла (пассивация), тогда как в последнем случае сам металл является термодинамически стабильным, и таким образом предотвращается выход ионов металла из решетки в раствор.[Pg.261]
Хотя первое промышленное применение анодной защиты было сделано совсем недавно, в 1954 году, сейчас она широко используется, особенно в США и СССР. Это стало возможным благодаря недавней разработке оборудования, способного контролировать точные потенциалы при сильноточных выходах. Он применялся для защиты сосудов из мягкой стали, содержащих серную кислоту, размером до 49 м в диаметре и высотой 15 м, а коммерческое оборудование доступно для использования с резервуарами емкостью от 38 000 до 7 600 000 литров.Правильно спроектированная система анодной защиты оказалась одновременно эффективной и экономически жизнеспособной, но необходимо соблюдать осторожность, чтобы избежать перебоев в подаче электроэнергии или образования локальных активно-пассивных ячеек, которые приводят к нарушению пассивности и интенсивной коррозии. [Pg.273]
Программы на основе нитритов требуют относительно высокой нормы внесения, чтобы гарантировать, что все анодные области в системе полностью защищены от риска точечной коррозии. При недостаточной обработке обнажаются анодные области, которые подвержены локализованному питтингу в результате концентрирующей силы от окружающих катодных участков.[Pg.395]
См. Документы NACE Оливер В. Зиберт, Корреляция лабораторных электрохимических исследований с полевыми применениями анодной защиты, Характеристики материалов, т. 20, нет. 2, стр. 38-43, февраль 1981 г. Анодная защита, Характеристики материалов, т. 28, вып. 11, стр. 28 ноября 1989 г., адаптировано NACE из книги «Основы коррозии — введение». (Хьюстон, Техас. NACE, 1984, стр. 105-107) Дж. Ян Манро и Уинстон В. Шим, Анодная защита — ее действие и применение, т. 41, нет.5, pp. 22-24, May 2001, и в серии из двух частей, J. Ian Munro, Anodic Protection of White and Green Kraft Liquor Tankage, Part I, Electrochemistry of Kraft Liquors, and Part 11, Anodic Protection Design and System Operation. , Материалы Performance, т. 42, нет. 2, стр. 22–26, февраль 2002 г., и т. 42, нет. 3, pp. 24-28, March 2002. [Pg.11]
Несколько групп недавно показали (36,42,43,44), что фотоанодные материалы можно защитить от роторной коррозии с помощью анодно сформированной пленки «полипиррола». .(45) Работа была распространена (46) на поверхности фотоанодов, сначала «обработанные реагентом, который ковалентно закрепляет места инициации образования полипиррола. В результате получается более липкая полипиррольная пленка, которая лучше защищает Si n-типа от фотокоррозии. материал, полученный в результате полимеризации I, анодно образованный полипиррол 1 является электронным проводником. (45) Это может оказаться очень важным, поскольку скорость ионного транспорта окислительно-восстановительных полимеров может оказаться слишком медленной … [Стр.75]
Коррозия может контролироваться изоляцией металла от коррозионной среды путем подавления анодного растворения металла и подавления соответствующей катодной реакции.Изоляция подверженных коррозии металлов от агрессивных сред, вероятно, является наиболее общим механизмом защиты от коррозии, обеспечиваемой лакокрасочными пленками, герметиками и аналогичными материалами на основе полимеров. Эффективная изоляция требует, чтобы полимерные материалы обладали хорошими барьерными свойствами и оставались адгезивными в присутствии воды и продуктов коррозии металлов. Барьерные свойства и адгезионные аспекты контроля коррозии подробно обсуждаются в следующих разделах. [Стр.4]
Корабли защищены от коррозии с помощью жертвенных анодов.[Стр.164]
Следует опасаться использования анодной защиты, поскольку любая область, которая не поляризована полностью в пассивную область, будет растворяться с высокой скоростью. Оптимальный диапазон защиты показан на рис. 16. Поэтому анодная защита более восприимчива к наличию щелей, отложений или неправильному размещению поляризующих электродов, чем катодная защита. Если компонент катодно недостаточно защищен, максимальная скорость коррозии незащищенной области является нормальной скоростью коррозии открытого контура при анодной защите, недостаточная защита приводит к высокоскоростному растворению незащищенной области и, следовательно, может привести к неожиданным изменениям в карьере.В таких установках важно понимать, каким образом ток от системы анодной защиты распределяется по поверхности. Вопросы, связанные с распределением тока, подробно обсуждаются в главе 4. [Pg.72]
Анод, жертвенный — довольно легко окисляемый металл, например цинк, магний, алюминий, электрически связанный с металлической конструкцией, которая должна быть защищена от коррозии. . Из-за образования -> гальванического элемента окисляется расходуемый анод, а не защищаемый металл.Протекторные аноды — это старейшее и простейшее средство защиты от электрохимической коррозии. [Стр.31]
.
Анодная защита от коррозии — Большая химическая энциклопедия
В большинстве цилиндрических углеродно-цинковых элементов цинковый анод также служит контейнером для элемента. Цинковая банка изготавливается методом вытягивания или вытягивания. Ртуть [7439-97-6J] традиционно добавлялась в ячейку для улучшения коррозионной стойкости анода, но промышленность находится в процессе удаления этого материала из-за проблем, связанных с окружающей средой. Предотвращение коррозии особенно важно для цилиндрических ячеек из-за тенденции к питтингу цинковой банки, что приводит к перфорации и утечке электролита.Другие типы клеток, такие как плоские, не страдают от этой проблемы. [Pg.522]Предотвращение коррозии достигается за счет правильного выбора материала конструкции, с помощью физических средств (например, краски или металлические, фарфоровые, пластиковые или эмалевые покрытия или покрытия) или химических средств (например, легирование или покрытие). Некоторые металлы, например алюминия, становятся пассивными за счет образования инертной защитной пленки. В качестве альтернативы защищаемый металл может быть электрически связан с более легко корродирующим металлом, например.грамм. магний, служащий жертвенным анодом. [Стр.55]
Легкая анодная обработка и различные антикоррозионные обработки были разработаны производителями магния. [Pg.493]
Выбор сплава для конкретного применения основан на стоимости и коррозионной стойкости сплава в интересующей среде. Также можно подвергнуть выбранный сплав процессу, с помощью которого коррозионная стойкость выбранного материала может быть улучшена в приемлемых пределах.Некоторые из стратегий предотвращения коррозии и защиты сплавов на основе алюминия: (i) конструкция (ii) выбор сплава и герметики для швов (iii) анодные покрытия с термическим напылением алюминия (iv) ингибиторы (v) конверсионные и органические покрытия и ( vi) катодная защита. [Pg.235]
Стратегия предотвращения коррозии заключалась в обмотке клапана восковой лентой и использовании магниевых анодов. Камера была тщательно очищена, а клапаны обернуты вощеной лентой, как показано на рисунке 7.3. Так как в камеру входили ограниченное количество раз, проржавевшая лестница оставалась нетронутой, и вход в нее осуществлялся с помощью удерживающего устройства и / или переносной лестницы. [Pg.462]
Коррозия или ржавление железа является примером естественного гальванического элемента. Чтобы предотвратить коррозию, расходуемые аноды иногда прикрепляют к ржавчине из железа. Жертвенные аноды должны … [Pg.695]
Электролитическое растворение в азотной кислоте использовалось на заводах по переработке Саванна Ривер [B22] и Айдахо Qiemical [AlO, All] для растворения большого количества различных видов топлива и облицовочных материалов, включая урановые сплавы, нержавеющая сталь, алюминий, циркалой и нихром.В электролитическом растворителе, разработанном фирмой Du Pont [B22], изображенном на рис. 10.4, используются аноды и катоды из ниобия, причем первые покрыты платиной толщиной 0,25 мм для предотвращения анодной коррозии. Металлическое топливо, подлежащее растворению, удерживается в алюминиевом изоляционном каркасе, поддерживаемом ниобиевой корзиной, расположенной между анодом и катодом и электрически изолированной от них. Поверхности топлива, обращенные к катоду, подвергаются анодному растворению в таких реакциях, как … [Pg.471]
CP или другие системы защиты должны быть включены, если необходимо, на этапе проектирования судна.Система CP является вторичной защитой от коррозии, когда в покрытии образуются прослойки или трещины. В системах CP используются либо расходуемые цинковые аноды, либо системы подаваемого тока для уменьшения коррозии. Другое оборудование и материалы для предотвращения коррозии представляют собой инертные газы для удаления агрессивных газов. Также используются ингибиторы коррозии. [Стр.283]
Ингибиторы используются в суровых и суровых условиях, которые встречаются в ротационных плитах и гидростатических стерилизаторах. Среда состоит из горячей воды, пара и охлаждающей воды.Единый подход к этой проблеме может не дать решения. Для предотвращения коррозии была выбрана комбинация анодных, катодных и пленочных ингибиторов в зависимости от состава воды и материала оборудования. [Pg.304]
Иногда необходимость быть экологически приемлемой может привести к новым проблемам. Например, озон был предложен для замены биоцидов при отсутствии данных об эффективности хлорирования воды (60). Методы контроля коррозии могут иметь как положительные, так и отрицательные последствия, и, следовательно, перед тем, как приступить к применению метода предотвращения коррозии, необходимо вынести взвешенное суждение.Оловоорганические противообрастающие покрытия на судах были эффективны, но они загрязняли морскую воду, и поэтому их дальнейшее использование было запрещено. Использование кадмия в качестве расходуемого анода ограничено из-за его токсичности. Большое количество цинка используется для защиты стальных платформ в защищенных и мелководных водах моря, и влияние цинка на загрязнение вод не известно. [Pg.398]
Анодная и катодная реакции ((2.1) и (2.2)) — это только первые шаги в процессе образования ржавчины.Однако эта пара реакций имеет решающее значение для понимания коррозии и широко цитируется при любом обсуждении коррозии и предотвращения коррозии стали в бетоне. Реакции будут часто упоминаться в этой книге. [Стр.7]
| Рис. 13.23 I Жертвенные аноды — один из эффективных методов защиты от коррозии. Незащищенная железная или стальная труба, закопанная в землю, будет подвергаться высокому риску коррозии. При соединении заглубленной трубы с металлом, таким как магний, который легче окисляется, создается гальванический элемент с трубой в качестве катода.В случае заглубленной трубы электролитом служит сама почва. Анод называется жертвенным, потому что со временем он разъедается в результате окисления. Но заменить анод — который может быть не более чем металлическим блоком или колом — намного проще, чем заменить заглубленную трубу. |  |
По мере того, как вода проникает через покрытие, происходит небольшой гидролиз фосфата цинка, в результате чего образуются вторичные ионы фосфата.Эти ионы фосфата, в свою очередь, образуют защитный пассивный слой [53,54], который, будучи достаточно толстым, предотвращает анодную коррозию [55]. Пористость фосфатных покрытий тесно связана с защитными характеристиками покрытия [37]. Приблизительная формула фосфатированного металлического соединения … [Pg.32]
| Рис. 13.16 Водопроводная магистраль из ковкого чугуна, защищенная ленточной лентой и протекторными магниевыми анодами. (С разрешения Дина Рукса, West Coast Corrosion Prevention Ltd.) … |  |
Молекула полифосфата связывается с двухвалентным кальцием и другими ионами с образованием положительно заряженных коллоидные частицы, которые притягиваются к катоду и образуют защитную пленку. Поскольку некоторые ионы металлов, например, железа, также могут адсорбироваться на пленке, полифосфат также демонстрирует частичное анодное поведение, хотя в основном они являются катодными ингибиторами.Механизм предотвращения коррозии полифосфатами показан на рис. 6.12. [Pg.365]
Они являются эффективными ингибиторами железа и ряда металлов в самых разных водах. Как и хроматы, нитриты являются анодными ингибиторами и ингибируют систему, образуя пассивную пленку с оксидом железа. Это экологически безопасные ингибиторы. Помимо стали, нитриты также замедляют коррозию сплавов меди, олова и никеля при уровнях pH 9-10. Хромат — чрезвычайно эффективный ингибитор коррозии алюминиевых сплавов.Нитриты не следует использовать в открытых системах, так как они окисляются до нитратов в присутствии кислорода. [Pg.367]
Аноды изMg могут обеспечивать плотность тока от 21,5 до 32,28 мА / нФ, достаточную для защиты внутренней стенки резервуара для горячей воды из оцинкованной стали. Сообщается, что оцинкованные резервуары для горячей воды либо подвергаются коррозии в течение нескольких лет, либо, если они служат дольше этого срока, остаются исправными в течение 15-20 лет. Это подтверждается тем фактом, что образование накипи оказывает консервирующее или предотвращающее коррозию действие оцинкованной стали в жесткой воде.Мягкая вода может предотвратить образование накипи из-за локальной гальванической коррозии, которая может привести к перфорации. Предполагается, что если резервуар будет иметь катодную защиту в течение первого года или … [Pg.104]
.
