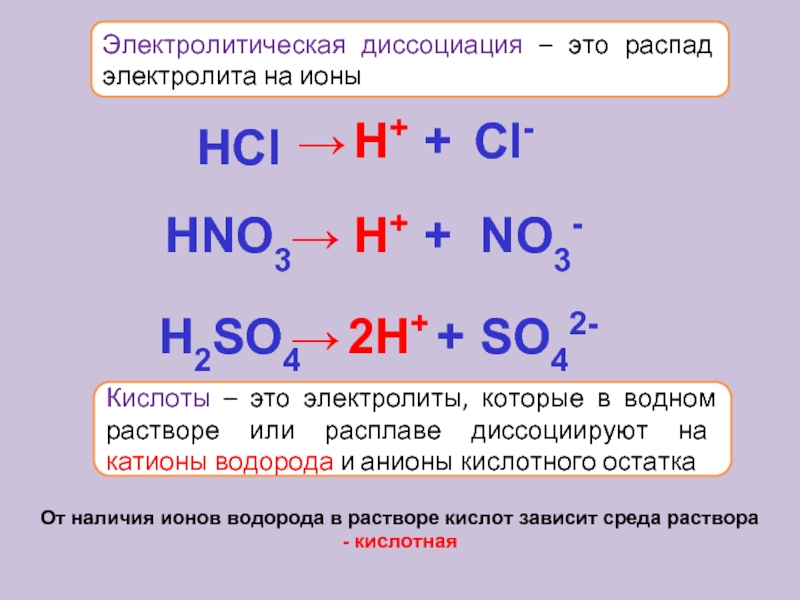
Уровень электролита в аккумуляторе: проверка, советы
Уровень электролита в аккумуляторе – это то, на что должен обращать внимание каждый автомобилист. Ведь от данного параметра зависит работоспособность автотранспорта, срок эксплуатации и частота обслуживания акб. Допустимо выполнение таких действий в домашних условиях.
Виды электролита
Автомобили комплектуются такими аккумуляторами:
- WET (свинцово-кислотные акб). Электролит представлен в виде водного раствора, включающего серную кислоту.
- AGM. Отличаются тем, что входящее в состав стекловолокно пропитано электролитическим составом.
- GEL (гелиевый акб). Электролит представлен в виде геля. Для этого в серно-водный раствор введена окись кремния.
Определять, сколько электролита в аккумуляторе, необходимо, если речь идет о свинцово-кислотных источниках питания.
Особенности проверки уровня электролита в автомобильном аккумуляторе
Регулярно проверяя уровень электролита в аккумуляторе, контролируя плотность, можно поддерживать автотранспорт, отдельные узлы в работоспособном состоянии. При необходимости проводят корректировку плотности, увеличивают или уменьшают уровень электролитического состава. Ведь использование источника питания, в котором электролитической жидкости меньше нормы, приводит к пагубным последствиям.
При необходимости проводят корректировку плотности, увеличивают или уменьшают уровень электролитического состава. Ведь использование источника питания, в котором электролитической жидкости меньше нормы, приводит к пагубным последствиям.
Просмотрите интересное видео про уровень электролита.
Проверка уровня электролита
Информация о том, какой уровень электролита должен быть, присутствует в технической документации, которая прилагается к автотранспортному средству. Для проверки и контроля используется два метода, каждый из которых имеет свои особенности:
- На корпусе АКБ сосредоточены отметки max и min. Если корпус подготовлен из прозрачного материала, то легко определить количество электролитического состава. На основании полученной информации нужно принимать решение об уменьшении, увеличении дистиллированной воды.
 Такой способ малоэффективен, если корпус окрашен в черный цвет.
Такой способ малоэффективен, если корпус окрашен в черный цвет. - Уровень электролита в акб проверяют с помощью стеклянной, пластиковой трубочки. Диаметр трубки – 3–5 мм. Перед тем как ввести трубку, изымается пробка. Опускается трубка до момента соприкосновения с пластинами. Норма – 12 мм. Такая процедура проводится для каждой банки, входящей в состав аккумуляторной батареи.
Избыток электролитического состава изымается с помощью шприца. Этот же инструмент используется для введения подготовленного электролита или дистиллированной воды.
Для того чтобы определить уровень жидкости в необслуживаемых источниках питания, используются отметки на поверхности акб. Дополнительно применяется индикатор заряда.
Причины снижения уровня электролита
- Чрезмерное увеличение выдаваемого генератором напряжения.
- Деформация корпуса аккумуляторной батареи, появление микротрещин или других дефектов.
- КЗ внутри источника питания.
- Наличие свинцового осадка и мусора.

В кислотно-свинцовых источниках питания уровень дистиллята постепенно снижается. При этом неопытные автомобилисты пытаются исправить ситуацию, добавив водный раствор с введенной серной кислотой. В результате, увеличивается уровень и плотность. Это приводит к тому, что аккумуляторная батарея быстро выходит из строя, внутренняя часть стремительно разрушается.
Неправильно определенный уровень приводит к таким последствиям:
- Разрушение свинцовых пластин, формирование остатков и шлама.
- Со временем образуются мостики между включенными в состав пластинами. Такие мостики способствуют возникновению КЗ, снижению мощности.
- Появление подтеков, затрудняющих эксплуатацию аккумуляторной батареи.
- Окисление основных контактов.
- Выход из строя аккумуляторной батареи.
Определение плотности электролитического состава
К проверке плотности приступают после тщательной зарядки аккумуляторной батареи. Предварительно подготавливается прибор, при помощи которого устанавливается степень плотности. Чаще всего используется ареометр.
Чаще всего используется ареометр.
С банок, сосредоточенных в корпусе источника питания, изымаются пробки. В отверстие помещается ареометр, набирается немного электролитического состава. Поплавок, включенный в состав, содержит шкалу с соответствующими отметками, которая используется для определения степени плотности. Оптимальный показатель – 1,29-1,3 г/см3.
Для понижения степени плотности электролитического состава допускается применение дистиллята, который реализуется в специальных магазинах, аптеках. Процедура введения дистиллированной воды осуществляется поэтапно. При этом в каждой банке периодически измеряется этот показатель.
Повысить плотность сложнее, чем увеличить уровень электролита в акб. Ведь изначально изымается часть состава при помощи ареометра, другого инструмента. После этого вводится смесь с соответствующей плотностью. Иногда возникает потребность в полной замене жидкости. Выявить это можно, если знать, как проверить уровень, степень плотности.
Процедура замены электролита
Полную замену проводят при условии, что уровень плотности значительно снизился. Процедура имеет особенности, правила. Перед выполнением нужно подготовить:
Процедура имеет особенности, правила. Перед выполнением нужно подготовить:
- Смесь с соответствующей плотностью (около 1,29 г/см3).
- Тара, подходящая для размещения старого раствора.
- Ареометр или другой инструмент.
Запрещено переворачивать источник питания для последующего удаления водно-серного раствора. Ведь это приводит к разрушению свинцовых пластин, образованию мостиков и подтеков, замыканию.
Перед работой должно быть подготовлено все необходимое для защиты: перчатки из плотной резины, прочная одежда, защитные очки. Ведь попадание смеси на кожу провоцирует образование химических ожогов.
Для откачки старой смеси применяют «грушу» или другой инструмент. Откачиваемую жидкость помещают в специальную тару, отличающуюся стойкостью, прочностью.
Заливку новой смеси выполняют поэтапно, соблюдая правила, нормы.
Меры безопасности
При работе с растворами, в состав которых входит серная кислота, требуется выполнение таких правил:
- Все предметы одежды, элементы должны быть подготовлены из прочности и стойкого материала.

- Для хранения использованной электролитической смеси применяется стеклянная либо полиэтиленовая тара, оснащенная плотными крышками и оплеткой.
- Для заливки используется только качественный состав, реализуемый в специальных магазинах. Самостоятельная подготовка приемлема при условии, что человек обладает требуемым опытом и знаниями, инструментами.
- Замена электролитической смеси проводится только после отключения аккумуляторной батареи, ее демонтажа.
- Перед подключением источника питания проверяется состояние выводов, ликвидируются окислы.
Точно определить уровень, плотность электролитического состава несложно. Достаточно соблюдать правила и рекомендации, подготовленные специалистами. С особой тщательностью нужно выбирать помещение, в котором будут проводиться все работы. В помещении должна быть вентиляционная система. Ведь в смеси присутствует кислота, другие вещества.
Своевременная проверка основных показателей – залог эффективной работы аккумуляторной батареи.
Видео про проверку электролита в аккумуляторе
Плотность электролита в аккумуляторе — какая должна быть
Автомобильный аккумулятор предназначен для обеспечения бортовой сети транспортного средства и накопления энергии, которую вырабатывает генератор. Больше века кислотно-свинцовые батареи применяются в автомобильной промышленности и по-прежнему удерживают лидирующие позиции. Причина долголетия проста – высокая эффективность при дешевой себестоимости. Подобные батареи состоят из гальванических элементов, которые взаимодействуя с водным раствором серной кислоты, вырабатывают электрическую энергию. Такие источники питания имеют стабильную плотность электролита в аккумуляторе, отличаются высокой морозоустойчивостью и длительным сроком работы.
Такие источники питания имеют стабильную плотность электролита в аккумуляторе, отличаются высокой морозоустойчивостью и длительным сроком работы.
Плотность электролита
Электролит — это основной компонент аккумулятора, а именно, вещество, проводящее электрический ток вследствие распада на ионы в растворе. Основным свойством, которое необходимо знать при использовании АКБ в автомобиле, является
Непосредственно плотность зависит от температуры электролита (чем ниже температура, тем выше плотность). Работа аккумулятора – это чередование циклов разрядки и зарядки, во время которых происходит широкий спектр химических реакций. При разрядке батареи химическая энергия трансформируется в электрический ток, при зарядке электричество превращается в химическую энергию. Данные процессы оказывают серьезное влияние на плотность электролитического раствора. Процесс зарядки повышает плотность электролита, разряд элемента питания – понижает это значение.
Данные процессы оказывают серьезное влияние на плотность электролитического раствора. Процесс зарядки повышает плотность электролита, разряд элемента питания – понижает это значение.
Температура замерзания электролита в зависимости от плотности — Таблица 1
С помощью прибора ареометра можно замерить плотность электролита в аккумуляторе, а также точно определить степень зарядки АКБ. При полном разряде батареи, показатель плотности падает настолько, что между пластинами остается практически дистиллированная вода. Сульфат свинца, который избыточно вырабатывается во время разряда, полноценно не расходуется при зарядке батареи и покрывает свинцовые пластины белым налетом. Сульфатация негативно влияет на емкость аккумулятора, сокращая рабочий ресурс источника питания. Свинцовые пластины со временем начинают осыпаться, что приводит к короткому замыканию внутри батареи.
Поскольку электролит является смесью воды и кислоты, то плотность электролита в аккумуляторе может возрастать. При зарядке АКБ происходит электролиз – выкипание дистиллированной воды из корпуса, благодаря чему концентрация кислоты в растворе возрастает, увеличивая его плотность. Печальная перспектива электролиза очевидна. Потеря воды неизбежно приведет к уменьшению уровня жидкости. Свинцовые пластины оголятся и вступят в химическую реакцию с кислородом, что приведет к осыпанию свинца и выходу батареи из строя. Именно поэтому важно остановить зарядку батареи при первых признаках кипения жидкости и своевременно доливать дистиллят при низком уровне электролита в обслуживаемых батареях.
При зарядке АКБ происходит электролиз – выкипание дистиллированной воды из корпуса, благодаря чему концентрация кислоты в растворе возрастает, увеличивая его плотность. Печальная перспектива электролиза очевидна. Потеря воды неизбежно приведет к уменьшению уровня жидкости. Свинцовые пластины оголятся и вступят в химическую реакцию с кислородом, что приведет к осыпанию свинца и выходу батареи из строя. Именно поэтому важно остановить зарядку батареи при первых признаках кипения жидкости и своевременно доливать дистиллят при низком уровне электролита в обслуживаемых батареях.
Какая должна быть плотность электролита в аккумуляторе
Отечественные автовладельцы ведут отчаянный спор о правилах эксплуатации аккумуляторных батарей. Количество автомобилей стремительно растет, и каждый водитель пытается сформулировать свою позицию по данному вопросу. Даже среди профильных специалистов мнения существенно разнятся. Поэтому будем отталкиваться от рекомендаций производителей, ведь только разработчики элементов питания способны сформулировать нюансы эксплуатации собственных изделий. Любая новая АКБ имеет сопроводительную инструкцию, в которой конкретно прописаны мероприятия по техническому обслуживанию.
Любая новая АКБ имеет сопроводительную инструкцию, в которой конкретно прописаны мероприятия по техническому обслуживанию.
Аккумуляторная батарея негативно воспринимает и повышенную, и пониженную плотность электролита. Высокий показатель плотности активизирует химические процессы, делая электролит «агрессивным», что приводит к значительному снижению рабочего ресурса изделия. Низкая плотность уменьшит емкость АКБ, что способствует проблемам запуска силового агрегата, особенно в зимнее время. Именно по этой причине необходимо придерживаться значений, рекомендованных производителем. Плотность полностью заряженного нового аккумулятора должна составлять 1.27 г/см3 при температуре +25 °С. При жарком климате допускается понижение плотности на 0,01 г/см3 , а при морозах — на 0,01 — 0,02 г/см3 больше.
Плотность электролита в аккумуляторе зимой и летом
Современный аккумулятор – устройство, сбалансированное и беспричинно корректировать электролит бессмысленно. Плотность электролита в аккумуляторе 1.
Просто добавь воды: как оживить мёртвый аккумулятор
В свои права вступила зима, а значит, пора рассказать что-нибудь интересненькое и полезное про аккумуляторы – главные источники проблем автомобилиста в холодный сезон. Давайте проверим уровень электролита аккумуляторной батареи и при необходимости доведем его до нормы. Спойлер: если вы уверены, что ваш аккумулятор «необслуживаемый», то скорее всего, это не так. Оживить его всё равно можно.
Обслуживаемый или нет?
Электролит свинцовых батарей состоит из двух компонентов – серной кислоты и воды. В понижении уровня электролита виновата именно вода, которая со временем испаряется. В итоге часть пластин оказывается не погруженной в электролит, и аккумулятор теряет емкость. Если летом этот эффект можно не заметить безболезненно, зимой он наверняка подложит вам морозную утреннюю свинью…
У автовладельцев принято делить аккумуляторы на «обслуживаемые» и «необслуживаемые» по типу пробок на банках.
На деле «необслуживаемость» заключается в первую очередь в том, что аккумулятор изготовлен с добавками кальция в свинец электродов вместо старой доброй сурьмы, которая применялась десятки лет, – говорит Александр Казунин, заведующий аккумуляторной лабораторией НИИ автомобильной электроники и электрооборудования.
«Кальциевые» батареи обладают очень низкой интенсивностью электролиза воды, которая почти не испаряется из электролита в нормальных условиях эксплуатации. И поэтому в них часто отсутствуют пробки для контроля уровня электролита. Впрочем, надо понимать, что с появлением «кальциевых» батарей проблема выкипания электролита полностью не исчезла. Склонные к падению уровня электролита «сурьмяные» батареи до сих пор выпускаются и продаются, да и «кальциевая» запросто может потребовать контроля и доливки, если машина интенсивно ездит летом в городском цикле или, скажем, неисправен регулятор напряжения в генераторе.

Кальций может применяться только на отрицательных электродах батареи или на всех электродах. Аккумуляторы, у которых кальцием легированы все электроды, называют «кальций-кальциевыми» (Ca/Ca). Правда, плата за необслуживаемость уровня электролита – повышенная чувствительность к глубокому разряду. «Кальциевая» батарея, единожды посаженная «в ноль», как правило, не жилец…
Про воду
Часто даже в по-настоящему необслуживаемых батареях пробки всё-таки имеются, но они не отдельные, а закрепленные на общей пластмассовой пластине, которая сверху прикрыта фирменной наклейкой. На таких пробках нет явных признаков того, что их можно открыть. Но сделать это можно, и зачастую нужно. Поскольку уровень электролита может понизиться почти в любом типе аккумулятора.
Выровнять пониженный уровень электролита в аккумуляторе – несложно и недорого. Достаточно приобрести в автомагазине бутылку дистиллированной воды и долить ее посредством шприца или груши в каждую банку батареи, число которых у машины с 12-вольтовой бортсетью равно шести. Заглянув с фонариком в банки, можно увидеть пластмассовый язычок-«клювик», который является меткой уровня. Если его нет – вода доливается до полного покрытия пластин. После этого аккумулятор крайне желательно не грузить стартером, а подзарядить.
Заглянув с фонариком в банки, можно увидеть пластмассовый язычок-«клювик», который является меткой уровня. Если его нет – вода доливается до полного покрытия пластин. После этого аккумулятор крайне желательно не грузить стартером, а подзарядить.
Процедура эта проста и доступна любому автовладельцу. Единственное «узкое место» в этой истории — покупка дистиллированной воды. Обычно фасованная в бутылки по 1,5 литра «дистиллировка» выпускается конторами типа «Рога и копыта», и найти в продаже воду производства известного бренда автомобильной химии не так-то просто. А ввиду невысокой розничной и еще более низкой закупочной цены дистиллированной воды у производителей имеется нешуточный соблазн максимально сократить издержки и начать разливать под видом дистиллировки для АКБ воду из под крана… Тем более, что обманутый покупатель вряд ли станет предъявлять претензии: аккумулятор от обычной воды, безусловно, умрет, но произойдет это не мгновенно.
Вот типичный отзыв о некачественной дистиллированной воде от одного из форумчан «Уазбуки»:
«У меня как-то в багажнике завалялась нераспечатанная бутылка такой воды. Провалялась, наверное, месяца четыре. И как-то вознамерился я ее долить в систему охлаждения. Вскрыл бутылку, а оттуда такой тухлятиной несет — хоть убегай. Из какого болота набрали её…»
Провалялась, наверное, месяца четыре. И как-то вознамерился я ее долить в систему охлаждения. Вскрыл бутылку, а оттуда такой тухлятиной несет — хоть убегай. Из какого болота набрали её…»
TDS-метр
Проверить качество приобретенной дистиллированной воды можно разными методами. Самый правильный способ проверки из доступных в бытовых условиях – применение специализированного прибора, который называется TDS-метр. В китайских интернет-магазинах их полно, стоят они не слишком дорого, а точность вполне достаточна для наших нужд. Выглядит TDS-метр как карандаш с дисплеем и измеряет уровень общей минерализации (солесодержания) воды в единицах «ppm» — количестве частиц растворенных солей на миллион частиц водного раствора.
Измеряем воду из-под крана — 215 ppm. Измеряем дистиллированную воду из автомагазина – бутылка одного производителя показывает 8 ppm, второго – 7 ppm, а третьего, та, на которой написано «двойная очистка», — 0 ppm!
Последнему производителю, безусловно, респект! Продукт действительно высококачественный. Но и в случае, если ppm дистиллировки не равен нулю, волноваться не стоит. Небольшое число — в пределах допустимого. В конце концов, почти в любом советском учебнике по автомобильным эксплуатационным материалам в крайнем случае допускалось применение для электролита талой снеговой воды (не из городских сугробов, разумеется), ppm которой обычно составляет 10-20.
Но и в случае, если ppm дистиллировки не равен нулю, волноваться не стоит. Небольшое число — в пределах допустимого. В конце концов, почти в любом советском учебнике по автомобильным эксплуатационным материалам в крайнем случае допускалось применение для электролита талой снеговой воды (не из городских сугробов, разумеется), ppm которой обычно составляет 10-20.
Омметр
Во многих источниках предлагается проверять качество дистиллированной воды мультиметром в режиме омметра. Иными словами, просто измеряя ее сопротивление. Часто даже встречаются цифры: если сопротивление воды больше 30 килоом, это означает годность воды для аккумулятора.
На первый взгляд, выглядит здраво: мультиметр, в отличие от TDS-метра, встречается дома или в гараже гораздо чаще, чем последний. А количество ppm TDS-метр вычисляет косвенно, как раз через замер сопротивления воды.
Но тут есть принципиальное отличие: TDS-метр измеряет сопротивление на переменном токе, а омметр – на постоянном. А электрохимические процессы, начинающиеся в воде при пропускании постоянного тока, вносят очень большие погрешности. А когда к ним добавляются еще и совершенно случайные геометрические размеры измерительных электродов омметра, и расстояние между ними, взятое на глазок, параметры начинают хаотично скакать, меняясь в десятки раз. Так что мультиметр использовать для оценки качества дистиллята не стоит.
А электрохимические процессы, начинающиеся в воде при пропускании постоянного тока, вносят очень большие погрешности. А когда к ним добавляются еще и совершенно случайные геометрические размеры измерительных электродов омметра, и расстояние между ними, взятое на глазок, параметры начинают хаотично скакать, меняясь в десятки раз. Так что мультиметр использовать для оценки качества дистиллята не стоит.
Выпаривание
Следующий способ – визуальный. Он едва ли даст внятную оценку качества «дистиллировки», но хотя бы позволит выявить откровенное мошенничество, когда под видом деминерализованной воды вам подсовывают водопроводную.
Для этого теста нам нужен чистый кусочек стекла. Капаем на него две капли воды рядом друг с другом: той, что мы считаем дистиллированной, и воды из-под крана для наглядности. После чего ждем испарения воды, которое можно ускорить нагревом стекла на зажигалке. После испарения дистиллированная вода не оставляет практически никаких солевых разводов, пятно просто исчезает. Если же заметны явные солевые «круги» — вода, скорее всего, из водопровода…
Если же заметны явные солевые «круги» — вода, скорее всего, из водопровода…
На фото слева – солевое пятно от водопроводной воды, справа не видно ничего – там испарилась капля дистиллированной воды.
220 вольт
Ну и напоследок — еще один способ. Суровый челябинский – проверка сопротивления воды на переменном токе электрической сети 220 вольт. Как становится понятно, основан он на том, что обычная вода проводит электрический ток, дистиллированная – практически не проводит. Это тоже условный тест, не дающий результата в цифровом виде, но вполне пригодный для бытовых условий, а главное – наглядный. Процедура достаточно проста, но требует определенной осторожности в обращении с оголенными проводами под напряжением!
Собираем простейшую схему из электрического шнура с вилкой и патрона для лампы накаливания на 220 вольт. Примерно в середине двойного шнура разрезаем один из проводов и зачищаем концы. Теперь разрезанные концы выполняют только роль размыкателя. Вкручиваем лампу, вставляем на пробу вилку в розетку – лампа горит полным накалом. Теперь вынимаем вилку, разрезаем один из проводов пары, зачищаем оба конца на длину около сантиметра каждый и опускаем эти концы в стакан с тестируемой водой. Снова вставляем вилку в розетку. На дистиллированной воде лампа гореть не будет, а на водопроводной ее нить станет тлеть тускло-тускло, менее чем на четверть накала.
Вкручиваем лампу, вставляем на пробу вилку в розетку – лампа горит полным накалом. Теперь вынимаем вилку, разрезаем один из проводов пары, зачищаем оба конца на длину около сантиметра каждый и опускаем эти концы в стакан с тестируемой водой. Снова вставляем вилку в розетку. На дистиллированной воде лампа гореть не будет, а на водопроводной ее нить станет тлеть тускло-тускло, менее чем на четверть накала.
Ну, а теперь, когда ясно, какая вода действительно дистиллированная, а какая – нет, дело остаётся за малым: долить «правильную» воду в АКБ. Причём так, как мы описывали выше. И радоваться хорошей работе батареи.
Опрос
Что вы делаете, если АКБ плохо «крутит»?
Всего голосов:
ТЕОРИИ КИСЛОТ И ОСНОВАНИЙ На этой странице описываются теории кислот и оснований Аррениуса, Бронстеда-Лоури и Льюиса, а также объясняются взаимосвязи между ними. | |
Примечание: Текущие учебные программы уровня A ‘в Великобритании сосредоточены на теории Бренстеда-Лоури, но вы также должны знать о кислотах и основаниях Льюиса.Теория Аррениуса представляет только исторический интерес, и вряд ли она вам понадобится, если вы не занимаетесь разработкой идей в области химии. | |
Теория кислот и оснований Аррениуса Теория Нейтрализация происходит потому, что ионы водорода и ионы гидроксида реагируют с образованием воды. Ограничения теории Соляная кислота нейтрализуется как раствором гидроксида натрия, так и раствором аммиака.В обоих случаях вы получаете бесцветный раствор, который можно кристаллизовать, чтобы получить белую соль — хлорид натрия или хлорид аммония. Это явно очень похожие реакции. Полные уравнения: В случае гидроксида натрия ионы водорода из кислоты реагируют с ионами гидроксида из гидроксида натрия — в соответствии с теорией Аррениуса. Однако в случае с аммиаком, похоже, нет никаких гидроксид-ионов! Но если вы внимательно посмотрите на уравнения, аммиак находится в растворе — NH 3 (водн.) .Аммиак реагирует с водой следующим образом: Это обратимая реакция, и в типичном разбавленном растворе аммиака около 99% аммиака остается в виде молекул аммиака. Тем не менее, там есть ионы гидроксида, которые реагируют с ионами водорода точно так же, как ионы гидроксида из гидроксида натрия. Таким образом, вы можете почти оправдать аммиак как основание по определению Аррениуса — он действительно производит ионы гидроксида в растворе. Но большая часть реакции будет прямой реакцией между молекулами аммиака и ионами водорода, что не соответствует определению Аррениуса. Такая же реакция происходит между газообразным аммиаком и газообразным хлористым водородом. В этом случае в растворе нет ионов водорода или гидроксид-ионов — потому что нет никакого раствора. Теория Аррениуса не считала бы это кислотно-щелочной реакцией, несмотря на то, что она дает тот же продукт, что и когда два вещества находились в растворе. Это глупо! Теория кислот и оснований Бренстеда-Лоури Теория Связь между теорией Бронстеда-Лоури и теорией Аррениуса Теория Бронстеда-Лоури никоим образом не противоречит теории Аррениуса — она лишь дополняет ее. Ионы гидроксида по-прежнему являются основаниями, потому что они принимают ионы водорода из кислот и образуют воду. Кислота производит ионы водорода в растворе, потому что она реагирует с молекулами воды, отдавая им протон. Когда газообразный хлористый водород растворяется в воде с образованием соляной кислоты, молекула хлористого водорода отдает протон (ион водорода) молекуле воды. | |
Примечание: Если вы не уверены в склеивании координат, перейдите по этой ссылке. Координатные связи будут упоминаться несколько раз на оставшейся части этой страницы. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Когда кислота в растворе реагирует с основанием, то, что на самом деле действует как кислота, является ион гидроксония.Например, протон передается от иона гидроксония к иону гидроксида с образованием воды. Показаны электроны, но без внутренних: Важно понимать, что всякий раз, когда вы говорите об ионах водорода в растворе, H + (водн.) , на самом деле вы говорите об ионах гидроксония. Проблема хлористого водорода / аммиака Это больше не проблема с использованием теории Бронстеда-Лоури.Независимо от того, говорите ли вы о реакции в растворе или в газообразном состоянии, аммиак является основанием, потому что он принимает протон (ион водорода). Водород присоединяется к неподеленной паре на азоте аммиака через координационную связь. Если он находится в растворе, аммиак принимает протон от иона гидроксония: Если реакция происходит в газообразном состоянии, аммиак принимает протон непосредственно от хлористого водорода: В любом случае аммиак действует как основание, принимая ион водорода из кислоты. Сопряженные пары Когда хлористый водород растворяется в воде, почти 100% его реагирует с водой с образованием ионов гидроксония и хлорид-ионов. Хлороводород — сильная кислота, и мы склонны записывать это как одностороннюю реакцию: | |
Примечание: Я намеренно пропускаю символы состояния в этом и следующем уравнении, чтобы сосредоточиться на важных битах.  Более подробную информацию о сильных и слабых кислотах вы найдете на другой странице в этом разделе. | |
Фактически, реакция между HCl и водой обратима, но только в очень незначительной степени. Для обобщения рассмотрим кислотную ГК и думайте, что реакция обратима. Размышляя о прямой реакции : Но также существует обратная реакция между ионом гидроксония и ионом A — : Обратимая реакция содержит двух кислот и двух оснований.Мы думаем о них парами, называемыми сопряженными парами . Когда кислота HA теряет протон, она образует основание A — . Когда основание A — снова принимает протон, оно, очевидно, повторно связывает кислоту, HA. Эти двое — сопряженная пара. Члены пары конъюгатов отличаются друг от друга наличием или отсутствием переносимого иона водорода. Если вы думаете о HA как о кислоте, то A — является ее сопряженным основанием. Если вы думаете об A — в качестве основания, то HA — это его сопряженная кислота. Вода и ион гидроксония также являются сопряженной парой. Если рассматривать воду как основание, ион гидроксония — это сопряженная с ней кислота, потому что у нее есть дополнительный ион водорода, который он может снова отдать. Если рассматривать ион гидроксония как кислоту, то вода является его сопряженным основанием. Вода может снова принять ион водорода, чтобы преобразовать ион гидроксония. Второй пример сопряженных пар Это реакция между аммиаком и водой, которую мы рассмотрели ранее: Сначала подумайте о прямой реакции.Аммиак является основанием, потому что он принимает ионы водорода из воды. Ион аммония является его сопряженной кислотой — он может снова высвободить этот ион водорода, чтобы преобразовать аммиак. Вода действует как кислота, а сопряженное с ней основание — ион гидроксида. Ион гидроксида может принимать ион водорода для преобразования воды. Если посмотреть на это с другой стороны, ион аммония — это кислота, а аммиак — сопряженное с ней основание. Ион гидроксида является основанием, а вода — его сопряженной кислотой. Амфотерные вещества Возможно, вы заметили (хотя, вероятно, нет!), Что в одном из последних двух примеров вода действовала как основание, тогда как в другом — как кислота. Вещество, которое может действовать как кислота или основание, описано как амфотерное . | |
Примечание: В этом контексте вы также можете встретить термин амфипротический .Эти два слова связаны между собой, и их легко спутать. Амфипротное вещество — это вещество, которое может как отдавать ионы водорода (протоны), так и принимать их. Но помимо того, что эти соединения являются амфипротонными, они также являются амфотерными . Амфотерный означает, что они вступают в реакцию как с кислотами, так и с основаниями. Так в чем разница между этими двумя терминами? Все амфипротические вещества также являются амфотерными, но обратное неверно. Есть амфотерные вещества, которые не отдают и не принимают ионы водорода, когда действуют как кислоты или основания. Существует совершенно новое определение кислотно-основного поведения, с которым вы вот-вот столкнетесь (теория Льюиса), которое вовсе не обязательно связано с ионами водорода. Кислота Льюиса — акцептор электронной пары; Основание Льюиса является донором электронной пары (см. ниже). Некоторые оксиды металлов (например, оксид алюминия) являются амфотерными — они реагируют как кислоты, так и основания. Например, они реагируют как основания, потому что ионы оксида принимают ионы водорода для образования воды. Это не проблема с точки зрения определения амфипротона, но проблема с реакцией как с кислотой. Оксид алюминия не содержит ионов водорода, которые можно было бы отдавать! Но оксид алюминия реагирует с основаниями, такими как раствор гидроксида натрия, с образованием сложных алюминатных ионов. Вы можете представить себе неподеленные пары на ионах гидроксида как образующие дативные ковалентные (координатные) связи с пустыми орбиталями в ионах алюминия. Ионы алюминия принимают неподеленные пары (действуя как кислота Льюиса). Таким образом, оксид алюминия может действовать как кислота и основание — и поэтому он амфотерный. Но это не амфипротон, потому что и кислотной реакции и реакции основания не вовлекают ионы водорода. Я провел более 40 лет преподавания (в лаборатории, через книги и Интернет), ни разу не использовал термин амфипротический! Я просто не вижу в этом смысла.Термин амфотерный охватывает все без исключения вещества, функционирующие как кислоты и основания. Термин амфипротический можно использовать только тогда, когда обе эти функции включают перенос ионов водорода — другими словами, его можно использовать только в том случае, если вы ограничены разговором о теории Бронстеда-Лоури. Лично я бы придерживался более старого, более полезного термина «амфотерный», если только ваша программа не требует, чтобы вы использовали слово «амфипротический». | |
Теория кислот и оснований Льюиса Эта теория выходит далеко за рамки того, что вы обычно считаете кислотами и основаниями. Теория Связь между теорией Льюиса и теорией Бронстеда-Лоури Базы Льюиса Проще всего увидеть взаимосвязь, посмотрев, что именно делают основания Бронстеда-Лоури, когда они принимают ионы водорода. Теория Бренстеда-Лоури утверждает, что они действуют как основания, потому что соединяются с ионами водорода.Причина, по которой они объединяются с ионами водорода, заключается в том, что у них есть неподеленные пары электронов — это то, что говорит теория Льюиса. Эти два полностью согласуются. Так как это расширяет концепцию базы? На данный момент это не так — просто смотрит на это под другим углом. А как насчет других подобных реакций, например, аммиака или воды? Согласно теории Льюиса, любая реакция , в которой аммиак или вода использовали свои неподеленные пары электронов для образования координационной связи, будет считаться их действием в качестве основания. Вот реакция, о которой вы найдете на странице, посвященной скоординированному связыванию. Аммиак реагирует с BF 3 , используя его неподеленную пару, чтобы сформировать координационную связь с пустой орбиталью на боре. Что касается аммиака, то он ведет себя точно так же, как и когда он реагирует с ионом водорода — он использует свою неподеленную пару для образования координационной связи. Если вы собираетесь описать его как основу в одном случае, имеет смысл описать его как базу и в другом случае. | |
Примечание: Если вы еще не прочитали страницу о склеивании координат, сделайте это сейчас. Вы найдете важный пример использования воды в качестве основы Льюиса, а также этот пример — хотя термин , основание Льюиса на этой странице не используется. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
кислоты Льюиса Кислоты Льюиса являются акцепторами электронных пар.В приведенном выше примере BF 3 действует как кислота Льюиса, принимая неподеленную пару азота. Согласно теории Бренстеда-Лоури, в BF 3 нет ничего даже отдаленно кислого. Это расширение термина кислота , выходящее далеко за рамки обычного использования. А как насчет более очевидных кислотно-основных реакций — таких как, например, реакция между аммиаком и газообразным хлористым водородом? То, что точно принимает неподеленную пару электронов на азоте.В учебниках часто пишут так, как будто аммиак отдает свою неподеленную пару иону водорода — простому протону без электронов вокруг него. Это заблуждение! Обычно в химических системах не бывает свободных ионов водорода. Они настолько реактивны, что всегда привязаны к чему-то другому. В HCl нет несоединенных ионов водорода. Нигде на HCl нет пустой орбитали, которая могла бы принять пару электронов. Почему же тогда HCl — это кислота Льюиса? Хлор более электроотрицателен, чем водород, а это означает, что хлористый водород будет полярной молекулой.Электроны в связи водород-хлор будут притягиваться к хлорному концу, оставляя водород слегка положительным, а хлор слегка отрицательным. | |
Примечание: Если вы не уверены в электроотрицательности и полярности связи, возможно, будет полезно перейти по этой ссылке. Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Неподеленная пара на азоте молекулы аммиака притягивается к слегка положительному атому водорода в HCl.По мере приближения электроны в связи водород-хлор еще больше отталкиваются к хлору. В конце концов, между азотом и водородом образуется координационная связь, и хлор отрывается в виде хлорид-иона. Это лучше всего показано с помощью обозначения «фигурная стрелка», обычно используемого в механизмах органических реакций. | |
Примечание: Если вас не устраивает использование фигурных стрелок для отображения движений электронных пар, вам следует перейти по этой ссылке.  Используйте кнопку НАЗАД в браузере, чтобы быстро вернуться на эту страницу. | |
Вся молекула HCl действует как кислота Льюиса. Он принимает пару электронов из аммиака и при этом распадается. Кислоты Льюиса не обязательно должны иметь пустую орбиталь. Заключительный комментарий к кислотам и основаниям Льюиса Если вы студент британского уровня A ‘, вы можете иногда встретить термины кислота Льюиса и основание Льюиса в учебниках или других источниках.Все, что вам нужно запомнить: | |
Примечание: Вспомните это, представив аммиак в качестве основания. Большинство людей на этом уровне знакомы с неподеленной реактивной парой на азоте, принимающей ионы водорода. Аммиак является основным из-за его неподеленной пары. Это означает, что базы должны иметь одиночные пары для пожертвования. Кислоты все наоборот. | |
Для всех общих целей придерживайтесь теории Бронстеда-Лоури.
В меню кислотно-щелочного равновесия. . . В меню «Физическая химия». . . В главное меню. . . © Джим Кларк, 2002 г. (последнее изменение — сентябрь 2018 г.) | |
Что такое лимонная кислота и вредна ли она для вас?
Лимонная кислота содержится в цитрусовых, особенно в лимонах и лаймах.Это то, что придает им терпкий, кислый вкус.
Промышленная форма лимонной кислоты обычно используется в качестве добавки в пищевые продукты, чистящие средства и пищевые добавки.
Однако эта промышленная форма отличается от того, что содержится в натуральных цитрусовых.
По этой причине вы можете задаться вопросом, хорошо это или плохо для вас.
В этой статье объясняются различия между натуральной и произведенной лимонной кислотой, а также исследуются ее преимущества, использование и безопасность.
Лимонная кислота была впервые получена из лимонного сока шведским исследователем в 1784 году (1).
Соединение без запаха и цвета производилось из лимонного сока до начала 1900-х годов, когда исследователи обнаружили, что его также можно сделать из черной плесени Aspergillus niger , которая создает лимонную кислоту, когда питается сахаром (1, 2).
Из-за своей кислой природы лимонная кислота преимущественно используется в качестве ароматизатора и консерванта, особенно в безалкогольных напитках и конфетах.
Он также используется для стабилизации или сохранения лекарств и в качестве дезинфицирующего средства против вирусов и бактерий.
РезюмеЛимонная кислота — это соединение, первоначально полученное из лимонного сока. Сегодня он изготавливается из пресс-формы определенного типа и используется в самых разных областях.
Цитрусовые и их соки — лучшие натуральные источники лимонной кислоты (3).
На самом деле слово «лимонный» происходит от латинского слова цитрус (2).
Примеры цитрусовых:
- лимонов
- лаймов
- апельсинов
- грейпфрутов
- мандаринов
- помело
Другие фрукты также содержат лимонную кислоту, но в меньших количествах. К ним относятся:
- ананас
- клубника
- малина
- клюква
- вишня
- помидоры
Напитки или пищевые продукты, содержащие эти фрукты, такие как кетчуп в случае помидоров, также содержат лимонную кислоту.
Хотя лимонная кислота не встречается в природе, она также является побочным продуктом производства сыра, вина и хлеба на закваске.
Лимонная кислота, указанная в ингредиентах пищевых продуктов и добавок, производится в естественных условиях, а не в цитрусовых (4).
Это связано с тем, что производство этой добавки из цитрусовых слишком дорого, а спрос намного превышает предложение.
РезюмеЛимоны, лаймы и другие цитрусовые являются преобладающими природными источниками лимонной кислоты.Другие фрукты, которые содержат гораздо меньше, включают определенные ягоды, вишню и помидоры.
Характеристики лимонной кислоты делают ее важной добавкой для различных отраслей промышленности.
В продуктах питания и напитках используется примерно 70% производимой лимонной кислоты, в фармацевтических и диетических добавках используется 20%, а оставшиеся 10% идут на чистящие средства (4).
Пищевая промышленность
Произведенная лимонная кислота — одна из самых распространенных пищевых добавок в мире.
Используется для повышения кислотности, улучшения вкуса и сохранения ингредиентов (5).
Газированные напитки, соки, порошковые напитки, конфеты, замороженные продукты и некоторые молочные продукты часто содержат промышленную лимонную кислоту.
Его также добавляют в консервированные фрукты и овощи для защиты от ботулизма — редкого, но серьезного заболевания, вызываемого продуцирующими токсин бактериями Clostridium botulinum .
Лекарства и пищевые добавки
Лимонная кислота является основным продуктом промышленности в лекарствах и пищевых добавках.
Его добавляют в лекарства для стабилизации и сохранения активных ингредиентов и используют для усиления или маскировки вкуса жевательных препаратов и лекарств на основе сиропа (6).
Минеральные добавки, такие как магний и кальций, могут содержать лимонную кислоту в форме цитрата, а также для улучшения абсорбции.
Дезинфекция и очистка
Лимонная кислота является полезным дезинфицирующим средством против различных бактерий и вирусов (7, 8, 9).
Исследование в пробирке показало, что он может быть эффективным при лечении или профилактике норовируса человека, основной причины болезней пищевого происхождения (10).
Лимонная кислота продается в коммерческих целях как дезинфицирующее и чистящее средство общего назначения для удаления мыльного налета, пятен от жесткой воды, извести и ржавчины.
Считается более безопасной альтернативой обычным дезинфицирующим и чистящим средствам, таким как четвертичный и хлорный отбеливатель (1).
РезюмеЛимонная кислота — это универсальная добавка для пищевых продуктов, напитков, лекарств и пищевых добавок, а также для чистящих и дезинфицирующих средств.
Лимонная кислота обладает множеством впечатляющих преимуществ для здоровья и функций.
Метаболизирует энергию
Цитрат — близкородственная молекула лимонной кислоты — является первой молекулой, которая образуется в процессе, называемом циклом лимонной кислоты.
Эти химические реакции, также известные как трикарбоновая кислота (TCA) или цикл Кребса, помогают преобразовывать пищу в полезную энергию (11).
Люди и другие организмы получают большую часть своей энергии из этого цикла.
Улучшает усвоение питательных веществ
Дополнительные минералы доступны в различных формах.
Но не все формы одинаковы, так как ваше тело использует некоторые более эффективно.
Лимонная кислота увеличивает биодоступность минералов, позволяя вашему организму лучше их усваивать (12, 13, 14).
Например, цитрат кальция не требует желудочного сока для абсорбции. Он также имеет меньше побочных эффектов, таких как газы, вздутие живота или запор, чем другая форма, называемая карбонатом кальция (15, 16).
Таким образом, цитрат кальция — лучший вариант для людей с пониженным содержанием желудочного сока, таких как пожилые люди.
Точно так же магний в цитратной форме всасывается более полно и более биодоступен, чем оксид магния и сульфат магния (17, 18, 19).
Лимонная кислота также улучшает усвоение добавок цинка (20).
Может защитить от камней в почках
Лимонная кислота — в форме цитрата калия — предотвращает образование новых камней в почках и разрушает уже образовавшиеся (21, 22, 23).
Камни в почках — это твердые образования, состоящие из кристаллов, которые обычно образуются в почках.
Лимонная кислота защищает от камней в почках, делая вашу мочу менее благоприятной для образования камней (24).
Камни в почках часто лечат лимонной кислотой, например цитратом калия. Однако употребление продуктов с высоким содержанием этой натуральной кислоты, таких как цитрусовые, может предложить аналогичные преимущества по предотвращению образования камней (3, 25).
РезюмеЛимонная кислота способствует энергетическому обмену, усвоению минералов, а также предотвращению или лечению камней в почках.
Производимая лимонная кислота обычно признана безопасной (GRAS) Управлением по контролю за продуктами и лекарствами (FDA) (5).
Не существует научных исследований безопасности производимой лимонной кислоты при ее потреблении в больших количествах в течение длительного времени.
Тем не менее, были сообщения о болезнях и аллергических реакциях на добавку.
В одном отчете была обнаружена боль в суставах с отеком и ригидностью, мышечная боль и боль в животе, а также одышка у четырех человек после того, как они потребляли продукты, содержащие искусственную лимонную кислоту (4).
Эти же симптомы не наблюдались у людей, употребляющих натуральные формы кислоты, такие как лимоны и лаймы.
Исследователи признали, что они не могут доказать, что изготовленная лимонная кислота является причиной этих симптомов, но рекомендовали продолжить изучение ее использования в продуктах питания и напитках.
В любом случае, ученые предположили, что симптомы, скорее всего, были связаны с плесенью, используемой для производства лимонной кислоты, а не с самим соединением.
РезюмеНебольшой отчет предполагает, что остатки плесени от производимой лимонной кислоты могут вызывать аллергию и другие заболевания, но это еще предстоит доказать.
Лимонная кислота естественным образом содержится в цитрусовых, но синтетические версии, полученные из плесени, обычно добавляют в пищевые продукты, лекарства, добавки и чистящие средства.
Хотя остатки плесени в процессе производства в редких случаях могут вызвать аллергию, лимонная кислота обычно считается безопасной.
Что такое электролит? Что нужно знать
Для разложения жидкости при электролизе требуются электролиты.
Чистая вода не проводит электричествоБольшинство людей могут не знать, но чистая вода — плохой проводник электричества.Когда в воду добавлен электролит, она легче проводит электричество. Когда добавляется соль, такая как пищевая сода (бикарбонат натрия) или даже поваренная соль (хлорид натрия), электричество может проходить через воду. Когда электричество постоянного тока (DC) пропускается через воду, она заставляет воду расщепляться на кислород и водород.
Итак, электролит предоставил ионы, растворенные в воде, которые помогли воде разделиться на части, когда электричество было доступно.
Электролиты позволяют производить энергию
Помните, что в приведенном выше определении электролиты — это ионизированные или ионизируемые компоненты живой клетки. Ионизируемый означает, что атом или группа атомов могут быть электрически заряженными.В автомобильном аккумуляторе также используется электролит. В этом случае электролит позволяет электричеству проходить на положительный вывод.
В организме человека электролиты выполняют аналогичную функцию.
Как и автомобильный аккумулятор, электролиты позволяют элементам вырабатывать энергию.
Электричество в организме человека требуется для выполнения ряда функций. Мозговые импульсы, кардиостимулятор обладают электрической проводимостью и даже сгибают и расслабляют мышцы.
Так же, как и жидкое тесто, электролиты контролируют кислотность организма.
Что такое электролиты?
Существует семь основных электролитов, важных для нашего организма.
• Натрий (Na +)
• Хлорид (Cl-)
• Калий (K +)
• Магний (Mg ++)
• Кальций (Ca ++)
• Фосфат (HPO4–)
• Бикарбонат (HCO3-)
Что такое электролит для наших клеток
В наших элементах для выработки энергии используются электролиты.Они также способствуют стабильности клеточных стенок.
Электролиты участвуют в выработке электричества, помогают в сокращении мышц и перемещают жидкости и воду в клетки и из клеток. Попадая в клетки нашего тела, электролиты участвуют в ряде дополнительных действий.
Гормоны контролируют концентрацию электролитов в нашем организме.
Специализированные датчики в наших почках отслеживают, сколько калия, натрия и воды удерживается в нашем кровотоке.
Чтобы поддерживать уровень электролитов, наши тела могут перемещать воду из места, где она не нужна, в область, в которой она больше всего нуждается. Когда наши тела находятся в состоянии засухи или если мы получаем избыток любого электролита, но поступает недостаточно воды, чтобы разбавить и удалить избыток, то может возникнуть избыток электролита.
Чего не хотят, чтобы вы знали производители пищевых добавок
Подумайте об этом: Поскольку наш организм не обрабатывает добавку так же, как пищу, у вас может развиться излишек.Считайте это передозировкой. Передозировка некоторых электролитов может иметь серьезные последствия для здоровья.При передозировке калия может появиться покалывание в руках и ногах. Вы можете испытывать мышечную слабость и даже временную потерю мышечной функции (так называемый паралич).
Еще хуже то, что нарушение сердечного ритма (называемое сердечной аритмией), которое может привести к остановке сердца.
Слишком много магния может вызвать падение артериального давления (так называемая гипотония).Тогда вялость, спутанность сознания, нарушение нормального сердечного ритма (так называемый сердечный ритм) и, в конечном итоге, ухудшение функции почек, связаны с тяжелой гипотонией. В самом тяжелом случае слишком большое количество добавок магния (так называемая гипермагниемия) может привести к остановке сердца.
Слишком много кальция (гиперкальциемия) в прошлом было результатом практики использования добавок кальция (от 1,5 до 16,5 г / день). Чаще всего передозировка возникает в результате сочетания карбоната кальция (антацидов) с молоком при лечении язвы желудка.
Симптомы могут включать спутанность сознания, бред, кому и, если не принять меры, смерть.
Кроме того, повышенное потребление кальция связано с повышенным риском рака простаты. Было обнаружено, что у них был риск развития рака простаты, который был в три раза выше, чем у мужчин, потребление кальция которых было менее 500 мг / день. Риск метастазирования или распространения рака на другие части тела также был в четыре раза выше.
В другом исследовании курильщики имели повышенный риск, если они принимали 1000 мг добавок кальция.
Но не все исследования показали связь между потреблением кальция и раком простаты. Исследование 2006 года показало, что прием кальция не увеличивает риск рака простаты (59. Severi G, English DR, Hopper JL, Giles GG. Re: Проспективные исследования потребления молочных продуктов, кальция и риска рака простаты: метаанализ. J Natl. Cancer Inst.2006; 98 (11): 794-795; ответ автора 795.).
Мы предполагаем, что состояние гидратации, а точнее, потребление чистой воды может играть роль в результатах.Вода может быть настолько важной, что может быть единственным фактором, изменившим результаты.
Определение электролитов: последние мысли
Мы смотрим на электролиты несколько иначе, чем большинство других. Хотя есть элементы, которые говорят о снижении количества соли, мы рекомендуем употреблять больше соли и вместе с ней больше воды. Мы рекомендуем употреблять меньше соли, чем содержится в физиологическом растворе внутривенно, например, в больнице.
При приеме электролитов безопасны только электролиты природного происхождения.Любые модифицированные, химически подобные или созданные человеком электролиты причинят вред организму. Только природные электролиты безопасны и дадут желаемый результат для здоровья.
Дополнительная информация об электролитах
Сколько воды нужно пить ежедневно?
Подробнее о протоколе лечения водой
Инъекции аминокислот: показания, побочные эффекты, предупреждения
Общее название: Amino Acid Injection (идентификатор MEE noe AS в JEK shun)
Фирменное наименование: AminoProtect, Aminosyn II, Aminosyn II / Electrolytes, Aminosyn M, Aminosyn,…показать все 40 торговых марок. Aminosyn-HBC, Aminosyn-PF, Aminosyn-RF, Aminosyn / Electrolytes, Clinimix E / Dextrose (2,75 / 10), Clinimix E / Dextrose (2,75 / 5), Clinimix E / Dextrose (4,25 / 10), Clinimix E / декстроза (4,25 / 25), Clinimix E / декстроза (4,25 / 5), Clinimix E / декстроза (5/15), Clinimix E / декстроза (5/20), Clinimix E / декстроза (5 / 25), Clinimix N14G30E, Clinimix N9G15E, Clinimix N9G20E, Clinimix / Декстроза (2,75 / 5), Clinimix / Декстроза (4,25 / 10), Clinimix / Декстроза (4,25 / 20), Clinimix / Декстроза (4,25 / 25), Clinimix / Декстроза (4.25/5), Клинимикс / Декстроза (5/15), Клинимикс / Декстроза (5/20), Клинимикс / Декстроза (5/25), Клинизол SF, FreAmine HBC, FreAmine III, Гепатамин, Нефрамин, Пленамин, Премасол, Просол , Synthamin 17, Travasol, TrophAmine, Trophamine
Медицинский осмотр на сайте Drugs.com. Последнее обновление 1 ноября 2020 г.
Использование инъекций аминокислот:
- Используется для питания организма.
Что мне нужно сказать своему врачу, прежде чем я приму инъекции аминокислот?
- Если у вас аллергия на инъекции аминокислот; любая часть введения аминокислоты; или любые другие лекарства, продукты питания или вещества.Расскажите своему врачу об аллергии и какие у вас были признаки.
- Если у вас есть какие-либо из этих проблем со здоровьем: высокий уровень аммиака в крови, низкий объем крови, проблемы с метаболизмом некоторых аминокислот, кислота в крови или проблемы с электролитами, или слишком много жидкости в легких.
- Если у вас есть какие-либо из этих проблем со здоровьем: заболевание почек или заболевание печени.
- Если у вас проблемы с мочеиспусканием.
Это не список всех лекарств или проблем со здоровьем, которые взаимодействуют с инъекцией аминокислот.
Расскажите своему врачу и фармацевту обо всех своих лекарствах (рецептурных или безрецептурных, натуральных продуктах, витаминах) и проблемах со здоровьем. Вы должны проверить чтобы убедиться, что для вас безопасно принимать инъекции аминокислот со всеми вашими лекарствами и проблемами со здоровьем. Не начинать, не останавливать и не изменять дозу любой препарат без консультации с врачом.
Что мне нужно знать или делать, пока я принимаю инъекции аминокислот?
- Сообщите всем своим поставщикам медицинских услуг, что вы делаете инъекции аминокислот.Сюда входят ваши врачи, медсестры, фармацевты и стоматологи.
- Сдайте анализ крови в соответствии с указаниями врача. Поговорите с доктором.
- Если у вас аллергия на сульфиты, обратитесь к врачу. Некоторые продукты содержат сульфиты.
- Это лекарство может содержать алюминий. Если вы длительное время принимаете инъекции аминокислот, существует вероятность отравления алюминием. Риск возрастет, если вы есть проблемы с почками. Риск также выше у недоношенных детей.Поговорите с доктором.
- Это лекарство можно смешивать с парентеральным питанием (ПП). Сгустки крови в легких, инфекции, высокий уровень сахара в крови и проблемы с печенью случилось с ПН. Иногда случаются летальные исходы от тромбов в легких. Если возникнут вопросы, поговорите с врачом.
- Если в этом продукте содержится декстроза и у вас высокий уровень сахара в крови (диабет), проконсультируйтесь с врачом.
- Если вам 65 лет и старше, используйте инъекции аминокислот с осторожностью.У вас может быть больше побочных эффектов.
- С осторожностью применять у детей. Поговорите с доктором.
- Сообщите своему врачу, если вы беременны или планируете беременность. Вам нужно будет рассказать о преимуществах и рисках использования инъекций аминокислот. пока вы беременны.
- Сообщите своему врачу, если вы кормите грудью. Вам нужно будет поговорить о любых рисках для вашего ребенка.
Как лучше всего принимать это лекарство (инъекции аминокислот)?
Используйте инъекции аминокислот в соответствии с предписаниями врача.Прочтите всю предоставленную вам информацию. Внимательно следуйте всем инструкциям.
- Его вводят в вену в течение определенного периода времени.
Что мне делать, если я пропустил дозу?
- Позвоните своему врачу, чтобы узнать, что делать.
По поводу каких побочных эффектов мне нужно немедленно позвонить своему врачу?
ПРЕДУПРЕЖДЕНИЕ / ВНИМАНИЕ: хотя это может быть редким явлением, у некоторых людей при приеме лекарства могут возникнуть очень тяжелые, а иногда и смертельные побочные эффекты.Сказать твоему Если у вас есть какие-либо из следующих признаков или симптомов, которые могут быть связаны с очень сильным побочным эффектом, немедленно обратитесь за медицинской помощью:
- Признаки аллергической реакции, например, сыпь; крапивница; зуд; красная, опухшая, покрытая волдырями или шелушащаяся кожа с лихорадкой или без нее; хрипы; стеснение в груди или горле; затрудненное дыхание, глотание или разговор; необычная охриплость; или отек рта, лица, губ, языка, или горло.
- Признаки проблем с жидкостью и электролитами, такие как изменение настроения, спутанность сознания, мышечная боль или слабость, сердцебиение, которое кажется ненормальным, очень сильное головокружение или обморок, учащенное сердцебиение, сильная жажда, судороги, чувство сильной усталости или слабости, отсутствие чувства голода, невозможность мочеиспускания или изменение состояния количество выделяемой мочи, сухость во рту, сухость в глазах или очень сильное расстройство желудка или рвота.
- Признаки повышенного уровня аммиака, такие как ненормальное сердцебиение, ненормальное дыхание, чувство замешательства, бледность кожи, замедление сердцебиение, судороги, потливость, рвота или подергивание.
- Признаки проблем с печенью, такие как темная моча, чувство усталости, отсутствие голода, расстройство желудка или боли в животе, светлый стул, рвота или желтая кожа или глаза.
- Признаки высокого или низкого кровяного давления, такие как сильная головная боль или головокружение, потеря сознания или изменение зрения.
- Изменение цвета кожи на синеватый, как на губах, ногтевых ложах, пальцах рук или ног.
- Сильно потеет.
- Одышка, значительное увеличение веса или отек рук или ног.
- Боль в груди.
- Кашель с кровью.
- Лихорадка или озноб.
- Это лекарство может вызвать раздражение вены. Если лекарство вытекает из вены, оно также может вызвать раздражение в этой области.Скажите медсестре, если вы есть покраснение, жжение, боль, отек или утечка жидкости в местах, где лекарство попадает в ваше тело.
Какие еще побочные эффекты у инъекций аминокислот?
Все препараты могут вызывать побочные эффекты. Однако у многих людей побочные эффекты отсутствуют или наблюдаются лишь незначительные побочные эффекты. Позвоните своему врачу или обратитесь за медицинской помощью поможет, если у вас есть побочные эффекты, которые вас беспокоят или не проходят.
Это не все возможные побочные эффекты.Если у вас есть вопросы о побочных эффектах, позвоните своему врачу. Позвоните своему врачу за медицинской помощью совет о побочных эффектах.
Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-332-1088. Вы также можете сообщить о побочных эффектах по адресу https://www.fda.gov/medwatch.
Если есть подозрение на ПЕРЕДОЗИРОВКУ:
Если вы считаете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью. Будьте готовы рассказать или показать, что было взяли, сколько и когда это произошло.
Как мне хранить и / или выбрасывать инъекции аминокислот?
- Если вам нужно хранить инъекции аминокислот дома, поговорите со своим врачом, медсестрой или фармацевтом о том, как их хранить.
Использование информации для потребителей
- Если ваши симптомы или проблемы со здоровьем не улучшаются или ухудшаются, позвоните своему врачу.
- Не делитесь своими наркотиками с другими и не принимайте чужие лекарства.
- Храните все лекарства в надежном месте. Храните все лекарства в недоступном для детей и домашних животных месте.
- Выбросьте неиспользованные или просроченные лекарства. Не спускайте воду в унитаз или в канализацию, если вам не сказали об этом. Свяжитесь со своим фармацевт, если у вас есть вопросы о том, как лучше всего выбросить лекарства. В вашем районе могут быть программы возврата наркотиков.
- К некоторым лекарствам может прилагаться еще один информационный буклет для пациента. Проконсультируйтесь с фармацевтом.Если у вас есть какие-либо вопросы об инъекциях аминокислот, обращайтесь с вашим врачом, медсестрой, фармацевтом или другим поставщиком медицинских услуг.
- Если вы считаете, что произошла передозировка, немедленно позвоните в токсикологический центр или обратитесь за медицинской помощью. Будьте готовы рассказать или показать, что было взяли, сколько и когда это произошло.
Дополнительная информация
Всегда консультируйтесь со своим лечащим врачом, чтобы информация, отображаемая на этой странице, соответствовала вашим личным обстоятельствам.
Заявление об отказе от ответственности за медицинское обслуживание
Катион против аниона: определение, диаграмма и периодическая таблица
Если атом или атомы имеют сбалансированное количество электронов (отрицательный заряд) и протонов (положительный заряд), они в целом нейтральны. Однако, если они не сбалансированы, с них будет взиматься плата. Эти заряженные частицы называются ионами .
Что такое катион?
Катион имеет больше протонов, чем электронов, что дает ему чистый положительный заряд.Для образования катиона один или несколько электронов должны быть потеряны, как правило, унесены атомами с более сильным сродством к ним. Количество потерянных электронов и, следовательно, заряд иона указываются после химического символа, например серебро (Ag) теряет один электрон и становится Ag + , в то время как цинк (Zn) теряет два электрона, превращаясь в Zn 2+ .
Что такое анион?
Анион имеет больше электронов, чем протонов, что, следовательно, дает ему отрицательный заряд.Для образования аниона необходимо получить один или несколько электронов, обычно оторванных от других атомов с более слабым сродством к ним. Число полученных электронов и, следовательно, заряд иона указывается после химического символа, например хлор (Cl) получает один электрон, чтобы стать Cl — , в то время как кислород (O) получает два электрона, чтобы стать O 2 — .
Таблица катионов и анионов
Основные различия между катионами и анионами приведены в таблице ниже.
Катион | Анион | |||||
Заряд | Положительный |
| ||||
Образуется | Атомы металла | Атомы неметаллов | ||||
| Хлорид (Cl - ), бромид (Br - ), сульфат ( SO 4 9 0058 2-) |
Металлические атомы относительно свободно удерживают часть своих электронов.Следовательно, они имеют тенденцию терять электроны и образовывать катионы. И наоборот, большинство неметаллических атомов притягивают электроны сильнее, чем металлические атомы, и поэтому получают электроны для образования анионов. Следовательно, когда атомы металлического и неметаллического элемента объединяются, неметаллические атомы стремятся отвести один или несколько электронов от металлических атомов с образованием ионов. Эти противоположно заряженные ионы затем притягиваются друг к другу, образуя ионные связи и производя ионные соединения без общего суммарного заряда. Примеры включают хлорид кальция (CaCl 2 ), йодид калия (KI) и оксид магния (MgO).
Катион против аниона Таблица Менделеева
Можно предсказать, образует ли атом катион или анион, на основе его положения в периодической таблице. Галогены всегда образуют анионы, щелочные металлы и щелочноземельные металлы всегда образуют катионы. Большинство других металлов образуют катионы (например, железо, серебро, никель), тогда как большинство других неметаллов обычно образуют анионы (например, кислород, углерод, сера). Однако некоторые элементы способны образовывать как катионы, так и анионы при правильных условиях.Одним из примеров является водород, который может приобретать (H - ) или терять (H + ) электрон, образуя гидридные соединения, такие как ZnH 2 (где это анион), и гидронные соединения, такие как H 2 О (где это катион).
Элементы 18-й группы периодической таблицы Менделеева - «благородные газы», как правило, не образуют ионы из-за расположения их электронов, которое делает их в целом инертными.
Размер катионов и анионов
Катионы и анионы бывают разных размеров в периодической таблице, как показано в этом видео.
Использование ионных свойств
Ионные свойства могут быть использованы химиками для различных целей. Ионообменная хроматография, например, полагается на сродство разделяемых молекул к неподвижной фазе на основе их зарядовых свойств, что делает возможным разделение.
Ионные свойства также играют ключевую роль в работе батарей. Батареи имеют два электрода, изготовленные из проводящего материала: катод, который является положительным концом, где электрический ток выходит / входят электроны, и анод, где электрический ток входит / электроны уходят.Между электродами находится жидкий электролит или гель, содержащий заряженные частицы - ионы. Когда это ионное вещество вступает в реакцию с электродами, оно генерирует электрический ток. В одноразовых сухих батареях цинк обычно используется в качестве анода, в то время как диоксид марганца является популярным выбором в качестве электролитного катода. Цинковый анод также действует как контейнер для угольно-цинковых батарей, так как он окисляется во время использования, и со временем содержимое может начать вытекать.
Углеродно-цинковая батарея с сухими элементами (слева) и щелочная батарея (справа).
В аккумуляторных батареях, таких как многие литий-ионные батареи, этот химический процесс является обратимым, а внутренняя структура отличается, что позволяет заряжать батареи.
Из-за ионных свойств соленой воды ученые в настоящее время стремятся использовать ионный потенциал генерирования электричества градиентов солености, где соленая вода смешивается с пресной водой, в качестве экологически чистого источника энергии для будущего.
PPT - презентация PowerPoint для жидкостей, электролитов и кислотно-щелочного баланса | бесплатно для просмотра
PowerShow.com - ведущий веб-сайт для обмена презентациями и слайд-шоу. Независимо от того, является ли ваше приложение бизнесом, практическими рекомендациями, образованием, медициной, школой, церковью, продажами, маркетингом, онлайн-обучением или просто для развлечения, PowerShow.com - отличный ресурс. И, что лучше всего, большинство его интересных функций бесплатны и просты в использовании.Вы можете использовать PowerShow.com, чтобы найти и загрузить примеры онлайн-презентаций PowerPoint ppt практически на любую тему, которую вы можете себе представить, чтобы вы могли узнать, как улучшить свои собственные слайды и презентации бесплатно.Или используйте его, чтобы найти и загрузить высококачественные презентации PowerPoint ppt с практическими рекомендациями и иллюстрированными или анимированными слайдами, которые научат вас делать что-то новое, также бесплатно. Или используйте его для загрузки собственных слайдов PowerPoint, чтобы вы могли поделиться ими со своими учителями, классом, студентами, руководителями, сотрудниками, клиентами, потенциальными инвесторами или всем миром. Или используйте его для создания действительно крутых слайд-шоу из фотографий - с двухмерными и трехмерными переходами, анимацией и музыкой на ваш выбор - которыми вы можете поделиться со своими друзьями в Facebook или в кругах Google+.Это тоже бесплатно!
За небольшую плату вы можете получить лучшую в отрасли конфиденциальность в Интернете или публично продвигать свои презентации и слайд-шоу с высокими рейтингами. Но в остальном это бесплатно. Мы даже преобразуем ваши презентации и слайд-шоу в универсальный формат Flash со всей их оригинальной мультимедийной красотой, включая анимацию, эффекты перехода 2D и 3D, встроенную музыку или другой звук или даже видео, встроенное в слайды. Все бесплатно. Большинство презентаций и слайд-шоу на PowerShow.com доступны для просмотра, многие даже можно бесплатно загрузить. (Вы можете выбрать, разрешить ли людям загружать ваши оригинальные презентации PowerPoint и слайд-шоу из фотографий за плату или бесплатно или вовсе.) Посетите PowerShow.com сегодня - БЕСПЛАТНО. Здесь действительно каждый найдет что-то для себя!
За небольшую плату вы можете получить лучшую в отрасли конфиденциальность в Интернете или публично продвигать свои презентации и слайд-шоу с высокими рейтингами. Но в остальном это бесплатно. Мы даже преобразуем ваши презентации и слайд-шоу в универсальный формат Flash со всей их оригинальной мультимедийной красотой, включая анимацию, эффекты перехода 2D и 3D, встроенную музыку или другой звук или даже видео, встроенное в слайды.Все бесплатно. Большинство презентаций и слайд-шоу на PowerShow.com можно бесплатно просматривать, многие даже можно бесплатно загрузить. (Вы можете выбрать, разрешить ли людям загружать ваши оригинальные презентации PowerPoint и слайд-шоу из фотографий за плату или бесплатно или вовсе.) Посетите PowerShow.com сегодня - БЕСПЛАТНО. Здесь действительно каждый найдет что-то для себя!

 Такой способ малоэффективен, если корпус окрашен в черный цвет.
Такой способ малоэффективен, если корпус окрашен в черный цвет.
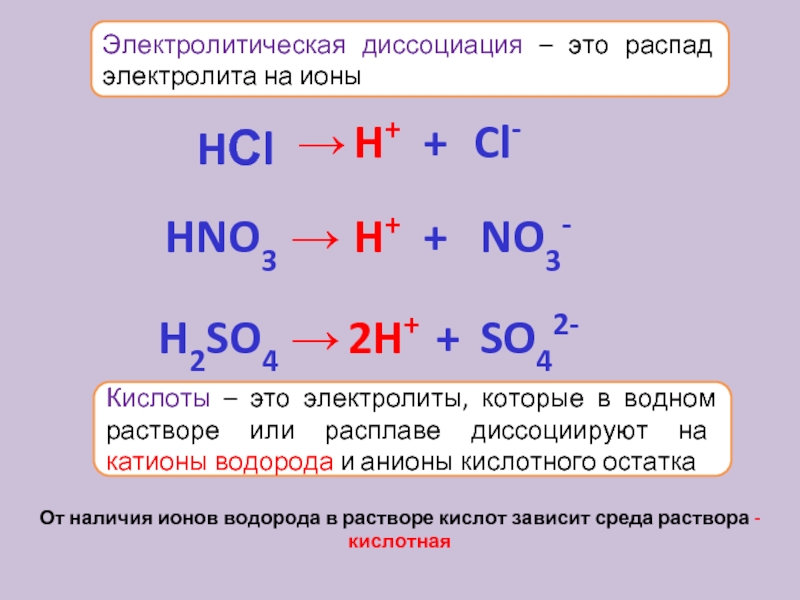

 Это также объясняет концепцию конъюгированной пары — кислота и сопряженное с ней основание или основание и сопряженная с ней кислота.
Это также объясняет концепцию конъюгированной пары — кислота и сопряженное с ней основание или основание и сопряженная с ней кислота.

 Координатная (дательная ковалентная) связь образуется между одной из неподеленных пар кислорода и водорода из HCl.Образуются ионы гидроксония, H 3 O + .
Координатная (дательная ковалентная) связь образуется между одной из неподеленных пар кислорода и водорода из HCl.Образуются ионы гидроксония, H 3 O + .


 Вода — хороший пример такого соединения. Вода действует как кислота (отдавая ионы водорода) и как основание (принимая их). «Протонная» часть слова относится к ионам водорода (протонам), которые либо передаются, либо принимаются. Другими примерами амфипротонных соединений являются аминокислоты и ионы, подобные HSO 4 — (которые могут терять ион водорода с образованием сульфатных ионов или принимать один с образованием серной кислоты).
Вода — хороший пример такого соединения. Вода действует как кислота (отдавая ионы водорода) и как основание (принимая их). «Протонная» часть слова относится к ионам водорода (протонам), которые либо передаются, либо принимаются. Другими примерами амфипротонных соединений являются аминокислоты и ионы, подобные HSO 4 — (которые могут терять ион водорода с образованием сульфатных ионов или принимать один с образованием серной кислоты).

 Мы рассмотрели три основания Бренстеда-Лоури — это гидроксид-ионы, аммиак и вода, и они типичны для всех остальных.
Мы рассмотрели три основания Бренстеда-Лоури — это гидроксид-ионы, аммиак и вода, и они типичны для всех остальных.