Akym » Насколько опасна кислота в автомобильном аккумуляторе?
В электролите, который находится внутри всех автомобильных аккумуляторов, содержится разбавленная серная кислота, поэтому они требуют очень осторожного обращения. Обязательно при работе с АКБ и тем более с электролитом надо использовать защитные средства: очки, перчатки и т.д. Если кислота, пусть даже и разбавленная попадет на кожу или в глаза, это может вызвать ожог.
Правила обращения с аккумуляторной кислотой
Существует ряд мер, которые помогут избежать серьезной опасности при работе с серной кислотой:
- Необходимо работать только в защитной одежде.
- Кислота, которая вдруг попала на кожу или одежду, следует как можно быстрее нейтрализовать раствором пищевой соды или нашатырного спирта, а затем место повреждения надо тщательно промыть водой.
- Если нейтрализатора под рукой нет, надо смыть кислоту большим количеством воды, после чего надо сразу же обратиться за врачебной помощью.

- При использовании обслуживаемых аккумуляторов иногда приходится изготавливать электролит самостоятельно. При самостоятельном смешивании кислоту надо вливать тонкой струей в воду. Делать наоборот — вливать воду в кислоту нельзя ни в коем случае! В этом случае смесь может начать брызгаться и капли концентрированной кислоты могут попасть на руки или лицо.
- Ставя батарею на зарядку, обязательно выкручивайте пробки, чтобы дать выход газам, которые очень активно выделяются в процессе восстановления АКБ. Это очень важно, так как кислота распадается и выделяется большое количество кислорода и водорода. Если они будут накапливаться внутри, риск взрыва батареи будет очень велик.
Техника безопасности при работе с автоаккумуляторами
Находясь вблизи аккумулятора, который заряжается, надо соблюдать осторожность и несколько простых правил:
- Так как газ, выделяемый при восстановительной реакции очень взрывоопасен, то нельзя допускать в помещении образования искр, нельзя заряжать АКБ вблизи открытого огня, мест для курения и т.
 д.
д. - Заряжать аккумулятор рекомендуется в хорошо проветриваемом месте с хорошей вентиляцией.
- При подключении контактов батареи к транспортному средству зажигание должно быть выключено.
- Когда отсоединяете стартерную батарею от автомобиля, первым отключается провод массы, а при подсоединении — наоборот, он подключается последним.
какая серная или соляная, какую заливают
Автор Акум Эксперт На чтение 8 мин Просмотров 6.6к. Опубликовано
Практически каждый владелец автомобиля знает, что в автомобильном аккумуляторе есть кислота, но далеко не каждый может сказать, какие функции она выполняет. Из этой статьи мы узнаем, какая кислота в аккумуляторе автомобиля, для чего она нужна и как правильно приготовить электролит.
Какая кислота в аккумуляторе
Практически во всех свинцово-кислотных аккумуляторах, а именно они стоят в автомобилях в качестве стартерных, используется серная кислота (формула – H2SO4) или, как ее еще называют автомобилисты, аккумуляторная кислота.
Но заливается она в батареи не в чистом виде, а в виде водного раствора, который называется электролитом. Примерное соотношение кислоты к воде составляет 3:7 (30% концентрированной кислоты, 70% воды). Для приготовления электролита используется дистиллированная вода, очищенная от солей и других примесей, существенно ухудшающих качество раствора.
Важно! Нередко можно услышать, что в автомобильные аккумуляторы некоторых типов заливается соляная кислота. Это неверно. Свинцово-кислотных аккумуляторов, работающих на соляной кислоте, не существует.
Для чего она нужна
Кислота является важной частью аккумулятора. Она участвует в химических реакциях окисления и восстановления с электродами, благодаря чему возникает ЭДС. При зарядке батареи и подаче на нее обратной ЭДС эта же кислота позволяет аккумулятору накопить получаемую энергию, обеспечивая обратные химические реакции.
Какие процессы протекают при заряде и разряде
Чтобы лучше понять, для чего нужна серная кислота, рассмотрим химические реакции, протекающие в аккумуляторе во время его работы и зарядки.
Как известно, аккумулятор имеет два электрода – анод и катод. Первый изготовлен из диоксида свинца (PbO2), второй – из металлического свинца (Pb). Оба электрода, естественно, погружены в электролит.
Упрощенная конструкция свинцово-кислотного аккумулятораПри подключении к АКБ нагрузки (режим разряда) начинается реакция взаимодействия оксида свинца и серной кислоты, при этом металлический свинец окисляется до сульфата свинца. В это время происходит восстановление диоксида свинца на катоде и окисление свинца на аноде. При заряде протекают обратные реакции.
Электрохимические реакции в свинцово-кислотной аккумуляторной батарее (слева направо — при разряде, справа налево — при заряде)При разряде аккумулятора из электролита расходуется серная кислота и выделяется относительно более лёгкая вода, плотность электролита падает. При заряде АКБ происходит обратный процесс.
Даже в нормальном режиме в процессе работы батареи некоторая часть воды разлагается на газообразный водород и кислород, но при нарушении условий эксплуатации (чрезмерный разрядный или зарядный ток) электролиз усиливается, и вода необратимо теряется.
Мнение эксперта
Алексей Бартош
Специалист по ремонту, обслуживанию электрооборудования и промышленной электроники.
Задать вопросВ обслуживаемых аккумуляторах проблема решается доливкой дистиллированной воды. Если устройство необслуживаемое, потеря воды означает конец срока службы аккумуляторной батареи.
Состав электролита и как его приготовить в домашних условиях
Обычно электролит заливают в батарею при ее изготовлении, но в некоторых случаях, к примеру, при покупке сухозаряженного обслуживаемого аккумулятора, раствор кислоты заливается самим покупателем, то есть нами. Прежде чем электролит залить, его нужно приготовить.
То, что в свинцовом аккумуляторе серная кислота, мы выяснили, что ее нужно разбавить водой – тоже. Знаем даже пропорции, но очень примерные. То, какой плотности электролит заливать, будет зависеть от климатических условий, в которых будет эксплуатироваться батарея, и от плотности исходного электролита. Поэтому с понятием плотности придется познакомиться поближе.
Итак, плотность чистой серной кислоты равняется 1.83 г/см3. То есть один миллилитр концентрированной серной кислоты будет весить 1.83 грамма. Плотность воды – 0.998 г/см3 (цифры для температуры +20 °С). Если смешать кислоту с водой, то плотность электролита будет зависеть от соотношения компонентов. Таким образом, совсем не нужно отмерять нужное количество жидкостей, достаточно во время приготовления электролита контролировать его плотность.
Более того, при приготовлении электролита пересчитывать плотность в процентное соотношение кислоты к воде вообще не нужно, поскольку в документации на все аккумуляторные батареи производитель указывает необходимую концентрацию электролита именно в единицах плотности.
Как измерить плотность электролита
Для измерения плотности жидкости используются специальные приборы – ареометры. Автомобилистами используются два основных типа ареометров: постоянной массы и многопоплавковые.
Ареометр постоянной массы (слева) и многопоплавковыйПервый тип представляет собой поплавок со шкалой в верхней его части и грузом в нижней. Такой прибор просто опускается в жидкость (в нашем случае электролит). Чем плотность электролита выше, тем на меньшую глубину погрузится поплавок. Показания же плотности считываются со шкалы в зависимости от глубины погружения.
Такой прибор просто опускается в жидкость (в нашем случае электролит). Чем плотность электролита выше, тем на меньшую глубину погрузится поплавок. Показания же плотности считываются со шкалы в зависимости от глубины погружения.
Автомобильный ареометр постоянной массыВажно. Для аккумулятора такой ареометр не подходит – его не опустишь в банку. Поэтому автомобильные ареометры дополняются специальным «шприцем» с относительно тонкой иглой для забора электролита из банки.
Что касается многопоплавкового типа, то принцип его работы тот же, но поплавков несколько (обычно 7). Каждый из них имеет определенную плавучесть, заставляющую его всплывать при той или иной плотности жидкости.
Работают с прибором так: забирают в него электролит (он тоже в виде шприца) и определяют плотность по последнему всплывшему поплавку – каждый из них отмаркирован своей плотностью всплывания. Недостаток такой конструкции очевиден – это очень низкая точность измерения.
С понятием плотности разобрались, пора готовить электролит. Для этого нам понадобится серная кислота и дистиллированная вода. Первую можно купить в автомагазине, вторую – в любой аптеке или в крайнем случае сделать самому, использовав перегонный куб (самогонный аппарат).
Какую кислоту использовать? В продаже обычно можно встретить разбавленную серную кислоту, так называемую автомобильную. Ее плотность составляет 1.42 г/см3. Если в нашем распоряжении окажется концентрированная серная кислота (плотность 1.83 г/см3), то подойдет и она, но работать с такой кислотой нужно очень осторожно – она прожигает одежду и кожу мгновенно.
Чистая серная кислота тоже подойдет для приготовления электролитаТеперь определим примерные пропорции, чтобы по 20 раз не перемешивать и не измерять плотность, «вылавливая» нужную концентрацию. Для этого воспользуемся табличками, приведенными ниже.
Пропорции воды к серной кислоте плотностью 1. 83 г/см3
83 г/см3
Необходимая плотность электролита, г/см3 | Количество воды, л | Количество кислоты, л |
1.2 | 0.859 | 0.2 |
1.21 | 0.849 | 0.211 |
1.22 | 0.839 | 0.221 |
1.23 | 0.829 | 0.231 |
1.24 | 0.819 | 0.242 |
1.25 | 0.809 | 0.253 |
1.26 | 0.8 | 0.263 |
1.27 | 0.791 | 0.274 |
1.28 | 0.781 | 0.285 |
1.29 | 0.772 | 0.295 |
1. | 0.749 | 0.319 |
Пропорции воды к серной кислоте плотностью 1.42 г/см3
Необходимая плотность электролита, г/см3 | Количество воды, л | Количество кислоты, л |
1.2 | 0.547 | 0.476 |
1.21 | 0.519 | 0.5 |
1.22 | 0.491 | 0.524 |
1.23 | 0.465 | 0.549 |
1.24 | 0.438 | 0.572 |
1.25 | 0.41 | 0.601 |
1.26 | 0.382 | 0.624 |
1.27 | 0.357 | 0.652 |
1.28 | 0. | 0.679 |
1.29 | 0.302 | 0.705 |
1.31 | 0.246 | 0.76 |
Какое количество электролита понадобится? В аккумуляторах емкостью 55-75 А/ч залито от 2,6 до 3,7 литров электролита в зависимости от емкости и конструкции батареи.
Теперь нужно решить, какая плотность раствора должна быть в нашем аккумуляторе. Она зависит от климатических условий, в которых будет эксплуатироваться автомобиль. Для определения оптимальной плотности конкретно для наших условий воспользуемся еще одной табличкой.
Зависимость плотности электролита полностью заряженной батареи от температуры эксплуатации
Климатический район (средняя месячная температура в январе, °С) | Время года | Плотность электролита полностью заряженного аккумулятора, г/см3 |
| Очень холодный (-50 … -30) | Зима | 1. |
| Лето | 1.28 | |
| Холодный (-30 … -15) | Круглый год | 1.28 |
| Умеренный (-15 … -8) | Круглый год | 1.28 |
| Теплый влажный (0 … +4) | Круглый год | 1.23 |
| Жаркий сухой (-15 … 0) | Круглый год | 1.23 |
Готовить электролит будем в кислотостойкой (к примеру, стеклянной) посуде, перемешивать стеклянной палочкой. Из средств защиты нужны очки, перчатки и по возможности прорезиненный фартук.
Мнение эксперта
Алексей Бартош
Специалист по ремонту, обслуживанию электрооборудования и промышленной электроники.
Задать вопросПрежде чем взяться за работу, твердо усвоим основное правило – льем кислоту в воду и ни в коем случае не наоборот. При вливании более легкой воды почти наверняка произойдет вскипание верхнего слоя раствора с разбрызгиванием кислоты!
Льем только кислоту в воду!Итак, отливаем необходимое количество воды в емкость. Теперь отмеряем нужное количество серной кислоты и аккуратно с небольшой высоты вливаем ее в воду тонкой струйкой. Льем очень медленно, поскольку при быстром вливании может произойти разбрызгивание. Кроме того, в процессе химических реакций температура раствора быстро поднимается, и стеклянный сосуд может лопнуть от резкого перепада температур.
Теперь отмеряем нужное количество серной кислоты и аккуратно с небольшой высоты вливаем ее в воду тонкой струйкой. Льем очень медленно, поскольку при быстром вливании может произойти разбрызгивание. Кроме того, в процессе химических реакций температура раствора быстро поднимается, и стеклянный сосуд может лопнуть от резкого перепада температур.
После этого тщательно, но не спеша, перемешиваем раствор и ждем, пока он не остынет до комнатной температуры, иначе показания ареометра будут неверными. Делаем забор электролита в ареометр и измеряем плотность. Если она отличается от желаемой, добавляем воду или кислоту (если плотность высокая – воду, если низкая – кислоту).
Важно! Воду доливаем в электролит только при помощи шприца ареометра! Забираем в него небольшое количество воды, опускаем иглу глубоко в электролит и потихоньку выжимаем воду грушей.
Снова перемешиваем раствор, остужаем и только потом, еще раз проконтролировав плотность, заливаем в аккумуляторную батарею.
Вот мы и узнали, для чего в аккумуляторе электролит, какой плотности он должен быть, и даже сможем самостоятельно его приготовить.
Что доливать в аккумулятор: воду или электролит?
Что доливать в аккумулятор: воду или электролит?Электролит представляет собой жидкость состоящую из серной кислоты и дистиллированной воды. В некоторых ситуациях уровень электролита в аккумуляторе падает и требуется его нормализовать. В зависимости от причин снижения уровня в батарею доливают либо электролит, либо дистиллированную воду. Как же узнать, что именно залить в АКБ?
В аккумулятор доливают электролит, если падение его уровня вызвано повреждением корпуса, либо вытеканием при наклоне. В аккумулятор доливают дистиллированную воду в тех случаях, когда произошло ее выкипание (испарение), т.к. выкипает именно вода, а не серная кислота.
Как доливать дистиллированную воду
Для доливки воды требуется именно дистиллированная вода. Сырая вода из под крана, либо кипяченная не подходит, т. к. содержит в себе примеси, которые негативно сказываются на протекании химических процессов и даже способны ухудшить состояние батареи, т.к. примеси оседают на элементах батареи. Кипячение не удаляет из воды жесткие примеси, соли и металлы, кипячением можно только убить бактерии и микробов в воде.
к. содержит в себе примеси, которые негативно сказываются на протекании химических процессов и даже способны ухудшить состояние батареи, т.к. примеси оседают на элементах батареи. Кипячение не удаляет из воды жесткие примеси, соли и металлы, кипячением можно только убить бактерии и микробов в воде.
Марка дистиллированной воды, которую будете заливать, значения не имеет. У батареи выкручиваются пробки и аккуратно доливается вода до уровня, который нанесен на моноблоке. Если моноблок не прозрачный, то доливают столько воды, чтобы скрыть электроды полностью, а запас воды сверху составлял не менее 1 см.
После процедуры доливки воды, батарею рекомендуется зарядить на зарядном устройстве. Полностью заряженная батарея будет иметь плотность 1,26-1,28. Если плотность значительно отличается, то что-то пошло не так и вам лучше обратиться к специалистам.
Как доливать воду в необслуживаемый аккумулятор без доступа к банкамдоливка воды в аккумулятор
На практике без доступа в банки делают необслуживаемые аккумуляторы по кальциевой технологии, т. е. которые не требуют доливки жидкости на протяжении всего срока службы. Но случается, что при перезаряде выкипание все же происходит. Если доступа в аккумулятор нет, а долить жидкость нужно, то придется помучатся. Рекомендуется высверлить в крышке АКБ небольшие отверстия 2-4 мм. и в них шприцом аккуратно долить дистиллированную воду.
е. которые не требуют доливки жидкости на протяжении всего срока службы. Но случается, что при перезаряде выкипание все же происходит. Если доступа в аккумулятор нет, а долить жидкость нужно, то придется помучатся. Рекомендуется высверлить в крышке АКБ небольшие отверстия 2-4 мм. и в них шприцом аккуратно долить дистиллированную воду.
Что будет, если вместо воды долить электролит
Если в батарею требуется долить дистиллированную воду, а вы дольете электролит, то после зарядки батареи его плотность превысит 1,30 и содержание серной кислоты станет запредельным. Это приведет к ускоренной сульфатации пластин батареи и выходу его из строя. Аккумуляторы с повышенной плотностью существуют и используются на крайнем севере, чтобы в батареи не образовывался лед, но при этом сам аккумулятор в таком состоянии способен отработать не более 1 года.
Как доливать электролит в аккумулятор
Перед тем, как электролит в аккумулятор заливать, его требуется сначала приготовить. В батарею можно доливать только электролит плотностью 1,26-1,29. Корректирующий электролит плотностью 1,40 можно доливать лишь в том случае, когда залили дистиллированной воды больше, чем этого требовалось и плотность даже после зарядки не поднялась для рекомендованного значения. В продаже можно найти готовый электролит, который можно сразу доливать в банки батареи. Корректирующий электролит придется разбавлять дистиллированной водой. Здесь нужно быть предельно внимательный и соблюдать строгие правила техники безопасности. Есть один серьезный нюанс – электролит (серная кислота) тяжелее воды, поэтому воду доливают в электролит, а не наоборот. В противном случае процесс разбавления будет сопровождаться брызгами, которые могут попасть на оголенные участки кожи.
В батарею можно доливать только электролит плотностью 1,26-1,29. Корректирующий электролит плотностью 1,40 можно доливать лишь в том случае, когда залили дистиллированной воды больше, чем этого требовалось и плотность даже после зарядки не поднялась для рекомендованного значения. В продаже можно найти готовый электролит, который можно сразу доливать в банки батареи. Корректирующий электролит придется разбавлять дистиллированной водой. Здесь нужно быть предельно внимательный и соблюдать строгие правила техники безопасности. Есть один серьезный нюанс – электролит (серная кислота) тяжелее воды, поэтому воду доливают в электролит, а не наоборот. В противном случае процесс разбавления будет сопровождаться брызгами, которые могут попасть на оголенные участки кожи.
Замена электролита в аккумуляторе
Замена электролита в аккумуляторе – процедура не только бесполезная, но и наоборот вредная. Срок службы аккумулятора подходит к концу в основном из-за оплывания активной массы – она с пластин осыпается на дно аккумулятора в виде шлама.
Дело в том, что шлам скапливается на дне моноблока, а при опрокидывании его для сливания электролита шлам перемещается на внутреннюю часть крышки батареи и в следствии попадает на оголенные элементы электродов, которые сверху не защищены сепараторами-изоляторами. В итоге происходит замыкание в одной или нескольких банках аккумулятора.
Кое-что об аккумуляторах
В настоящем материале мы постараемся кратко, без химических формул и замудренных профессиональных терминов рассказать обобщенный нами материал об аккумуляторных батареях. Если он Вам пригодиться – мы будем очень рады, что наши старания не пропали даром.Дадим некоторые понятия, связанные с аккумуляторными батареями:
— электрод или токоотвод – это, попросту говоря, свинцовая решетка (пластина), на которую наносится активная масса;
— активная масса – это специально приготовленная смесь из пасты со свинцовым порошком, присадками, которые контактируют с электролитом и образуют электрический поток;
— сепаратор – такой конверт из специального пористого материала, в который помещается один из электродов, чтобы предотвратить короткое замыкание между разнополярными токоотводами.

Остальное по ходу рассказа.
Свинцовые стартерные аккумуляторы являются наиболее массовым и недорогим химическим источником тока, благодаря относительной дешевизне используемых материалов и высокой степени автоматизации производства.
В ходе разряда аккумулятора активная масса обоих электродов превращается из губчатого свинца в сульфат свинца. При этом на формирование сульфата свинца расходуется серная кислота, что вызывает снижение концентрации электролита и, как следствие, снижение его плотности.
Когда реакции преобразования веществ в активных массах положительного и отрицательного электродов завершены, плотность электролита перестает меняться, что служит признаком завершения заряда аккумулятора. При дальнейшем продолжении заряда протекает так называемый вторичный процесс — электролитическое разложение воды на кислород и водород.
 Выделяясь из электролита в виде пузырьков газа, они создают иллюзию кипения электролита, что тоже служит признаком завершения процесса заряда.
Выделяясь из электролита в виде пузырьков газа, они создают иллюзию кипения электролита, что тоже служит признаком завершения процесса заряда. Традиционные автомобильные аккумуляторы с высоким содержанием сурьмы имеют недостатки, связанные с тем, что сурьма способствует бурному газовыделению в процессе зарядки батареи, что приводит к потерям воды.
В конце 90-х годов в США и Западной Европе начинается производство аккумуляторов с токоотводами из свинцово-кальциевого сплава с многокомпонентными добавками, в том числе и серебра, которые при глубоких разрядах теряют емкость гораздо медленнее, чем первое поколение аккумуляторных батарей по свинцово-кальциевой технологии. Расход воды у них так мал, что конструкторы убирают с крышек отверстия для доливки воды и делают аккумуляторные батареи полностью необслуживаемыми и исключающими доступ к электролиту при использовании аккумулятора.
Такое изменение конструкции стало возможным благодаря общим усилиям производителей аккумуляторов и автомобильного электрооборудования.
 Ведь для максимального использования ресурса полностью необслуживаемой аккумуляторной батареи (без отверстий для доливки воды) необходимо обеспечить стабильное зарядное напряжение, обеспечивающие минимальное разложение воды при заряде аккумуляторов. В то же время, степень заряженности аккумуляторной батареи должна быть достаточной для безотказной работы всего электрооборудования. Это стало возможно благодаря созданию системы регулирования зарядного напряжения, обеспечивающей его стабильность с точностью ± 0,1 В.
Ведь для максимального использования ресурса полностью необслуживаемой аккумуляторной батареи (без отверстий для доливки воды) необходимо обеспечить стабильное зарядное напряжение, обеспечивающие минимальное разложение воды при заряде аккумуляторов. В то же время, степень заряженности аккумуляторной батареи должна быть достаточной для безотказной работы всего электрооборудования. Это стало возможно благодаря созданию системы регулирования зарядного напряжения, обеспечивающей его стабильность с точностью ± 0,1 В. 
С некоторых времен на аккумуляторных батареях появились индикаторы, показывающие состояние заряженности аккумулятора (их в народе называют еще и глазками). По мере того, как происходит заряд аккумуляторной батареи и увеличивается плотность электролита, шарик всплывает со дна трубки индикатора и показывает, что аккумулятор заряжен (как правило, этот шарик окрашен в зеленый цвет). Но необходимо помнить, что эта величина соответствует минимальной степени заряженности (62-64% от номинального значения), при которой индикатор начинает давать информацию о работоспособности аккумуляторной батареи в пусковом режиме. Последующее увеличение плотности электролита (до 100 % заряда) не меняет показания индикатора, что является недостатком данного приспособления. В случаях понижения уровня электролита до оголения пластин, информация индикатора о состоянии заряженности батареи прекращается. Поэтому степень заряженности аккумуляторной батареи лучше определять, измеряя напряжение на выводных клеммах.

При работающем индикаторе его информация относится только к одной из шести банок (ячеек) аккумуляторной батареи. В тех случаях, когда появляется дефект в другой банке, где нет индикатора, информация индикатора становится бесполезной, не отражающей общее состояние (работоспособность) аккумуляторной батареи. Использование индикатора дает полезную информацию об общем состоянии батареи в тех случаях, когда она не содержит дефекта.
А что же такое гелевые аккумуляторы? Это такие же свинцово-кислотные аккумуляторные батареи, только в них используется загуститель, такие как силикагель, аллюмогель, которые при смачивании серной кислотой образуют гелеобразный электролит.. В качестве сепараторов в подавляющем большинстве герметизированных гелевых аккумуляторов используют высокопористые стекломаты из ультратонких волокон. Их применяют не только для батарей с гелеобразным электролитом, но и для аккумуляторов с адсорбированным жидким электролитом. В последнем случае технология производства немного дешевле, но емкостные показатели хуже, чем у автомобильных аккумуляторов с гелеобразным электролитом.

Нормальная эксплуатация гелевых герметизированных свинцовых автомобильных аккумуляторов возможна при соблюдении гораздо более жесткого диапазона регулирования зарядного напряжения, чем при эксплуатации необслуживаемых аккумуляторов с жидким электролитом (даже не имеющих отверстий для доливки воды). Максимальная величина зарядного напряжения для автомобильных аккумуляторных батарей с загущенным (гелеобразным) и адсорбированным электролитом зависит от рекомендаций производителя (ориентировочно для гелеобразных 14,35В, а для адсорбированных 14,4В). В случае превышения величины рекомендованной производителем на 0,05В скорость газовыделения становится так велика, что ведет к нарушению контакта активной массы электродов с электролитом, а также к высыханию аккумулятора, в результате чего батарея утрачивает работоспособность.
Весьма жесткие ограничения величины зарядного напряжения, наряду с гораздо более высокой стоимостью герметизированных автомобильных аккумуляторных батарей в сравнении с необслуживаемыми, создают определенные трудности для их широкого использования на автомобилях.
 Поэтому, прежде чем решить купить гелевый аккумулятор, а тем более на старенькую иномарку, нужно подумать, стоит ли игра свеч, т.к. гелевый аккумулятор значительно дороже обычного и более капризный к состоянию электрооборудования автомобиля.
Поэтому, прежде чем решить купить гелевый аккумулятор, а тем более на старенькую иномарку, нужно подумать, стоит ли игра свеч, т.к. гелевый аккумулятор значительно дороже обычного и более капризный к состоянию электрооборудования автомобиля.Концентрация электролита. Повышенная концентрация электролита отрицательно сказывается на сроке службы аккумулятора вследствие ускорения коррозионных реакций на положительном электроде. Поэтому оптимальная концентрация электролита устанавливается исходя из совокупности требований и условий, в которых эксплуатируются аккумуляторы. Так, например, для стартерных аккумуляторов, работающих в умеренном климате, рекомендована рабочая концентрация при которой плотность электролита равна 1,26-1,28 г/см3, а для районов с жарким (тропическим) климатом плотность электролита должна быть 1,22-1,25 г/см3.
Температура электролита. С понижением температуры разрядная емкость аккумуляторов понижается. Причина этого — повышение вязкости электролита и его электрического сопротивления, что замедляет скорость проникновения электролита в поры активной массы.

Часто встречается такое явление как саморазряд аккумуляторной батареи. Саморазрядом аккумуляторной батареи называют уменьшение емкости аккумуляторов при разомкнутой внешней цепи, то есть при бездействии. Это явление вызвано окислительно-восстановительными реакциями, самопроизвольно проходящими как на отрицательном, так и на положительном электродах. Саморазряду в особенности подвержен отрицательный электрод вследствие самопроизвольного растворения свинца (отрицательной активной массы) в растворе серной кислоты.
Саморазряд отрицательного электрода сопровождается выделением газообразного водорода. Скорость самопроизвольного растворения свинца существенно повышается с увеличением концентрации серной кислоты. Повышение плотности электролита с 1,27 до 1,32 г/см3 ведет к росту скорости саморазряда отрицательного электрода на 40%. Поэтому не нужно пытаться сделать так называемы «зимний» электролит, доливая концентрированную серную кислоту.
Саморазряд может возникать также, когда аккумулятор снаружи загрязнен или залит электролитом, водой или другими жидкостями, которые создают возможность разряда через электропроводную пленку, находящуюся между полюсными выводами аккумулятора или его перемычками.
 Этот тип саморазряда не отличается от обычного разряда очень малыми токами при замкнутой внешней цепи и легко устраняется. Для этого необходимо содержать поверхность автомобильного аккумулятора в чистоте.
Этот тип саморазряда не отличается от обычного разряда очень малыми токами при замкнутой внешней цепи и легко устраняется. Для этого необходимо содержать поверхность автомобильного аккумулятора в чистоте. Саморазряд аккумуляторов в значительной мере зависит от температуры электролита. С уменьшением температуры саморазряд понижается. При температуре ниже 0°С у новых аккумуляторных батарей он практически прекращается. Поэтому хранить автомобильные аккумуляторы рекомендуется в заряженном состоянии при низких температурах (до -30 °С). В течении эксплуатации саморазряд не остается постоянным и резко усиливается к концу срока службы.
На этом мы остановимся и прекратим вещать об аккумуляторах, чтобы не погрузить Вас в сон. Надеемся, что эта информация была полезна для Вас.
Удачи Вам на дорогах и пусть дураки не встречаются Вам на пути!
Приготовление электролита | Аккумуляторные батареи
Страница 14 из 26
4.3. Приготовление электролита для свинцовых аккумуляторов
Электролит для свинцовых аккумуляторов приготовляется путем разбавления чистой серной кислоты чистой водой. Кислота продается обычно концентрированной, удельного веса от 1,835 до 1,840. При разбавлении концентрированной кислоты раствор сильно нагревается. Во избежание опасности для лица, производящего смешивание, всегда необходимо наливать кислоту в воду, но не наоборот.
Кислота продается обычно концентрированной, удельного веса от 1,835 до 1,840. При разбавлении концентрированной кислоты раствор сильно нагревается. Во избежание опасности для лица, производящего смешивание, всегда необходимо наливать кислоту в воду, но не наоборот.
Хотя количество теплоты, развиваемой в обоих случаях, одно и то же, однако удельные теплоты воды и концентрированной кислоты совершенно различны. Струя воды, попадая в концентрированную кислоту, освобождает большое количество теплоты, которая благодаря низкой удельной теплоте кислоты вызывает сильное местное повышение температуры. Кислота, приливаемая к воде, не может вызвать столь же большого повышения температуры в силу того, что удельная теплота воды очень высока. Необходимо непрерывно перемешивать раствор все время, пока кислота подливается в воду, для того, чтобы помешать более тяжелой кислоте опуститься на дно сосуда, не смешавшись с водой.
Для смешивания и хранения небольших количеств электролита наиболее подходят сосуды фарфоровые, гончарные или стеклянные; но так как они легко дают трещины, то им следует предпочесть чаны, выложенные свинцом, особенно для более значительных количеств.
Никакие другие металлические сосуды, кроме свинцовых, непригодны.
После разбавления кислоты, до заливки ее в батарею, необходимо подождать, пока она остынет, для того чтобы избежать повреждений пластин и сепараторов.
Охлаждение можно ускорить, пользуясь струей сжатого воздуха, но воздух при этом должен быть чистым.
Избежать сильного повышения температуры при смешивании кислоты с водой можно, применяя вместо воды лед, приготовленный из дистиллированной воды. Понижение температуры происходит вследствие того, что скрытая теплота плавления льда приблизительно равна количеству теплоты, освобождающемуся при растворении серной кислоты. Лед, свободный от воды, можно прибавлять к кислоте непосредственно. Избыток поглощенной теплоты показывает, что раствор должен получить температуру ниже нуля, что и наблюдалось в действительности.
Чтобы облегчить приготовление электролитов любой требуемой концентрации, на рис. 4.1 приведены необходимые пропорции кислоты и воды. Аккумуляторные заводы обычно сообщают сведения о том, какой крепости кислоту следует применять для каждой данной батареи.
Аккумуляторные заводы обычно сообщают сведения о том, какой крепости кислоту следует применять для каждой данной батареи.
Рис. 4.1. Приготовление электролита любого удельного веса из концентрированной кислоты удельного веса 1,835.
1- содержание серной кислоты, %; 2 – требующаяся добавка воды по объему; 3 – то же по весу.
4.4. Приготовление электролита для кадмиевоникелевых и железоникелевых аккумуляторов
Для кадмиевоникелевых и железоникелевых аккумуляторов в качестве электролита служит раствор в дистиллированной воде едкого калия (КОН) или едкого натрия (NaOH).
В зависимости от температуры окружающего воздуха в аккумуляторах (табл. 4.1) применяется раствор соответствующей плотности (концентрации) основного компонента электролита в чистом виде или с добавкой едкого лития (LiOH).
Кадмиевоникелевые аккумуляторы рассчитаны на работу на холоде при температуре до – 40°С, причем при температурах +35…– 19°С с составным электролитом, а при более низких температурах, например, – 20. ..– 40°С с электролитом без добавки едкого лития.
..– 40°С с электролитом без добавки едкого лития.
При температурах – 20…– 40°С при отсутствии чистого едкого калия допускается как исключение применять составной электролит из едкого калия и едкого лития повышенной плотности, при этом емкость аккумулятора снижается на 10 – 15%. При отсутствии составного электролита из едкого калия и едкого лития при температуре – 19…+35°С можно воспользоваться составным электролитом из едкого натрия повышенной плотности 1,17 – 1,19 г/см3 с добавкой на 1 л раствора 20 г едкого лития, но при этом следует учесть, не гарантируется.
Таблица 4.1.
Рекомендуемые состав и плотность электролита для кадмиевоникелевых и железоникелевых аккумуляторов при различной температуре окружающего воздуха
Температура воздуха, °С | Рекомендуемый состав электролита | Плотность, г/см3 |
– 19. | Составной раствор едкого калия с добавкой на 1 л раствора 20 г едкого лития аккумуляторного (моногидрата лития) | 1,19 – 1,21 |
– 20… – 40 | Раствор едкого калия | 1,25 – 1,27 |
+10…+50 | Раствор едкого натрия с добавкой на 1 л раствора 15 – 20 г едкого лития (моногидрата лития) | 1,1 – 1,12 |
Не гарантируется также долговечность аккумуляторов при работе их с электролитом из раствора чистого едкого калия плотностью 1,19 – 1,21 г/см3, т. е. без добавки едкого лития при температуре –19… + 10°С. При работе при температуре + 10…+50°С с рекомендуемым составным электролитом плотностью 1,1–1,12 г/см3 (табл. 5.1) емкость аккумуляторов также снижается по сравнению с номинальной, а долговечность не гарантируется.
Железоникелевые аккумуляторы рассчитаны на работу в тех же условиях и с тем же электролитом, что и кадмиевоникелевые, но они более чувствительны к низким температурам, поэтому могут применяться при температурах не ниже –20° С.
В процессе эксплуатации температурные условия в зависимости от времени года резко изменяются, поэтому для более эффективного использования емкости аккумуляторов их следует заливать электролитом, по составу и плотности соответствующим этим условиям.
Кроме того, необходимо систематически контролировать количество электролита, т. е. следить за уровнем последнего и поддерживать его в установленных пределах.
В аккумуляторах, находящихся в эксплуатации, уровень электролита постепенно снижается вследствие испарения, поэтому его необходимо периодически измерять и при необходимости дополнять до нормы дистиллированной водой. Не реже чем через 10 циклов нужно проверять плотность электролита и также доводить ее до нормы добавлением раствора плотностью 1,41 г/см3 или дистиллированной воды.
Уровень электролита в аккумуляторах должен постоянно находиться выше края пластин не менее чем на 5 мм и не более чем на 12 мм.
Снижение уровня электролита ниже верхнего края пластин или сетки, а также повышение плотности электролита при положительных температурах окружающего воздуха снижают емкость и долговечность последних. Уровень электролита необходимо проверять и доводить до указанной нормы перед каждым зарядом. Он проверяется с помощью стеклянной трубки диаметром 5 – 6 мм с метками на высоте 5 и 12 мм от конца. Для установления уровня электролита в аккумуляторе надо конец трубки с метками ввести через заливное отверстие до упора в пластины или сетку, после чего другой конец трубки закрыть пальцем. Вынув трубку из аккумулятора по высоте столбика электролита в ней, определим уровень электролита над верхним краем пластин или сетки в аккумуляторе. Для снижения уровня электролита в аккумуляторе можно пользоваться пипеткой или резиновой грушей со стеклянным или пластмассовым наконечником длиной около 100 мм. Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра.
Доливку электролита или дистиллированной воды в аккумуляторы можно производить с помощью пипетки, резиновой груши или кружки через стеклянную воронку, размеры которых подбирают в зависимости от вместимости аккумуляторов. Проверка плотности электролита производится при помощи сифонного ареометра.
Проверку плотности электролита необходимо производить по возможности перед каждым зарядом, в каждом аккумуляторе, хотя и допускается выборочный контроль в 2 – 3 аккумуляторах батареи. В крайнем случае проверка должна проводиться не реже чем через 10 циклов во всех аккумуляторах батареи.
Таким образом, электролит необходим не только для первой заливки аккумуляторов при формировке, но и для замены, поддержания плотности и уровня электролита в действующих аккумуляторах, поэтому его требуется приготовлять и всегда иметь запас.
Для приготовления электролита поставляются следующие исходные материалы:
а) едкий калий аккумуляторный марки А (твердый) или марки В (жидкий) и едкий литий аккумуляторный;
б) составная щелочь сорта А – готовая смесь едкого калия и едкого лития в отношении едкий литий/едкий калий = 0,04. ..0,045;
..0,045;
в) едкий натрий аккумуляторный (сода каустическая) сорта А и едкий литий аккумуляторный;
г) составная щелочь сорта Б – готовая смесь едкого натрия и едкого лития в соотношении едкий литий/едкий натрий = 0,028…0,032.
Перед приготовлением электролита необходимо удостовериться, что имеющиеся в наличии химические ‘компоненты соответствуют приведенным выше требованиям и ГОСТам. Хранить эти материалы необходимо в герметически закрытой таре. Данные материалы могут поставляться как в жидком, так и в твердом состоянии в виде гранул, чешуек, кусков или слитка.
Приготовление электролита следует начинать с определения потребности в нем согласно норме расхода на один аккумулятор при первой заливке, указанной в табл. 4.2.
Определив требуемое количество электролита, приготовим примерно 3/4 этого объема свежей дистиллированной воды. При отсутствии последней допускается применение дождевой воды, собранной с чистой поверхности, или воды, полученной при таянии снега, а также конденсата.
Таблица 4.2
Ориентировочная норма расхода электролита на один аккумулятор при первой заливке
Тип | Норма расхода электролита при первой заливке, л | Тип | Норма расхода электролита при первой заливке, л |
АКН-2,25 | 0,04 | КН-60 | 0,75 |
Примечание. При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
При приготовлении электролита желательно норму увеличить на 10 – 15 % для создания резерва на отход и другие непредвиденные случаи.
В крайнем случае можно использовать любую сырую чистую питьевую воду (кроме минеральной).
Затем, пользуясь данными табл. 5.3, определяем необходимое количество химических компонентов: едкого калия или едкого натрия, а также едкого лития для добавки. Расход дистиллированной воды на 1 кг твердой и на 1 л жидкой щелочи для приготовления электролита необходимой плотности приведен в табл. 4.3.
Таблица 4.3
Расход дистиллированной воды, необходимой для приготовления электролита для кадмиевоникелевых и железоникелевых аккумуляторов
Щелочь | Плотность, г/смз3 | Количество воды, л | |
на 1 кг твердой щелочи | на 1 кг жидкой щелочи плотностью 1,41 г/см3 | ||
Калиевая или готовая составная, т. Калиево-литиевая Натриевая или готовая составная натриево-литиевая |
1,19 – 1,21 1,25 – 1,27
1,17– 1,19 |
3 2
5 |
1 0,55
1,5 |
Для определения массы твердых щелочей, необходимой по норме, приведенной в табл. 19, достаточно разделить:
на три требуемое количество воды, если необходимо приготовить калиевый или составной калиево-литиевый раствор плотностью 1,19 – 1,21 г/см3;
на два, если необходимо приготовить калиевый электролит для работы при температуре
– 20. ..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
..– 40° С или составной калиево-литиевый плотностью 1,25 –1,27 г/см3;
на пять, если необходимо приготовить натриевый или составной натриево-литиевый электролит плотностью 1,17 – 1,19 г/см3.
Если составная калиево-литиевая или натриево-литиевая щелочь отсутствуют, а имеется едкий калий, едкий натрий и едкий литий, то расчет потребности в твердых щелочах производится по тому же принципу, как указано выше. Следует иметь в виду, что в частном, полученном в результате деления, учитывается и масса едкого лития.
Технология залитого аккумулятора от VARTA®
VARTA® предлагает обширную линейку залитых свинцово-кислотных аккумуляторов для широкого диапазона автомобилей. Каждый аккумулятор создан, чтобы отвечать специфическим требованиям наших потребителей во всем мире — как производителей оборудования, так и покупателей на рынке компонентов.
Залитые свинцово-кислотные аккумуляторы являются наиболее распространенным типом аккумуляторов. Жидкий электролит, состоящий из серной кислоты и воды, покрывает все внутренние детали. Залитые аккумуляторы VARTA обладают герметичной конструкцией, поэтому они защищены от протеканий.
Жидкий электролит, состоящий из серной кислоты и воды, покрывает все внутренние детали. Залитые аккумуляторы VARTA обладают герметичной конструкцией, поэтому они защищены от протеканий.
Залитые аккумуляторы для легковых автомобилей
Наши залитые 12-вольтовые аккумуляторы разработаны, чтобы удовлетворять потребности в электроэнергии современных автомобилей, и обеспечивают надежную пусковую мощность снова и снова в самых сложных климатических условиях. В них используется наша эксклюзивная технология решетки PowerFrame®.
Залитые аккумуляторы для водного транспорта
Мы предлагаем широкий диапазон пусковых аккумуляторов и аккумуляторов глубокого цикла для водного транспорта, которые позволяют нашим покупателям дольше быть на воде. Мы предлагаем аккумуляторы для водного транспорта на любой вкус: от высокомощных стартерных аккумуляторов до стандартных или улучшенных аккумуляторов глубокого разряда с жидким электролитом. В отличие от стандартных залитых аккумуляторов, аккумуляторы VARTA Professional Dual Purpose защищены от разлива и позволяют наклонять себя до 90° на короткое время.
Преимущества:
- Стартерные аккумуляторы обеспечивают короткий и мощный импульс для запуска двигателя.
- Аккумуляторы глубокого разряда запускают двигатели и питают приборы, если двигатели не запущены.
- Более прочная конструкция с улучшенными характеристиками работы в циклическом режиме продлевают время эксплуатации для применений с глубоким разрядом.
Залитые аккумуляторы для гольф-мобилей
Нужен ли вам аккумулятор для перемещения по полю для гольфа или надежный источник энергии для промышленного применения, типа ножничных подъемников или поломоечных машин, наши аккумуляторы для гольф-мобилей обеспечивают необходимую производительность в режиме глубокого разряда.
Преимущества:
- Активная масса высокой плотности и сплав решетки со специальной формулой позволяют аккумулятору выдерживать нагрузку множественных циклов разряда.
- Механически соединенные отверстия для удобного долива воды.
- Прочные пластины и плотная установка компонентов для виброустойчивости.

Залитые аккумуляторы для газонокосилок и садовой техники
Наши аккумуляторы для газонокосилок и садовой техники разработаны так, чтобы обеспечивать надежную пусковую мощность раз за разом. Характеристики продукта:
- Удобная конструкция, не требующая обслуживания.
- Конверты-сепараторы защищают пластины, обеспечивают необычайную пусковую мощность и предотвращают от внутреннего замыкания.
Залитые аккумуляторы для тяжелых грузовиков
Наши аккумуляторы высокой мощности для коммерческого применения обеспечивают высочайшую производительность и увеличенный срок службы в циклах для самых сложных условий. Технология решетки PowerFrame® обеспечивает более длительный срок службы, устойчивость к коррозии и до 70 % лучшее прохождение тока.
Кроме того:
- Усиленные полюсные мостики и горячий компаунд на ушках пластин увеличивают устойчивость к вибрации.
- Встроенные складные ручки обеспечивают простую переноску и установку.

- Устойчивый к ударам корпус с усиленными торцевыми стенками для большей прочности.
- Прочные сепараторы предотвращают короткие замыкания.
Устройство и схема автомобильного аккумулятора
Устройство и схема автомобильного аккумулятора
Мы вспоминаем об аккумуляторе тогда, когда он сам напоминает о себе низким зарядом или неисправностью. Но посмотрите на этот тяжелый параллелепипед — что происходит за его пластмассовыми стенками? Откуда вообще в АКБ берется электричество? Понять это не сложно.
Полтора века истории
Трудно поверить, но свинцово-кислотный аккумулятор был изобретен свыше полутора века назад — это произошло во Франции в 1859-1860 годах. Создателем первого аккумулятора стал Гастон Планте, который занимался поиском надежных источников тока для физических опытов.
Свинцово-кислотный аккумулятор появился на свет после долгих раздумий и сотен экспериментов, а первый работоспособный образец был невероятно простым по сути и конструкции. Это была банка, наполненная разбавленной серной кислотой, в которую опущен «рулет» из двух сложенных свинцовых полос, разделенных куском сукна.
Это была банка, наполненная разбавленной серной кислотой, в которую опущен «рулет» из двух сложенных свинцовых полос, разделенных куском сукна.
Аккумулятор показал очень хорошие результаты, хотя, конечно, и имел некоторые недостатки, главный из которых — низкая емкость. Решить эту проблему смог Камилл Фор — в 1878 году ученый покрыл пластины свинцовым суриком, и с тех пор свинцово-кислотный аккумулятор, в общем, приобрел современные черты.
Устройство и схема автомобильного аккумулятора
Принцип запасания и извлечения электрической энергии, открытый Планте, используется и сейчас. Так что за прошедшие полтора столетия свинцово-кислотный аккумулятор изменился только технологически — стал более емким, простым в эксплуатации и надежным. А в сущности это все те же свинцовые пластины, опущенные в слабую серную кислоту.
Устроен аккумулятор довольно-таки просто. Основу всего составляет прочный корпус, выполненный из кислотоупорной пластмассы — моноблок. Внутри корпус разделен перегородками на шесть банок. Собственно, каждая банка — это и есть аккумулятор, а АКБ — это батарея аккумуляторов. Зачем так сделано? Не проще ли было сделать один большой аккумулятор?
Собственно, каждая банка — это и есть аккумулятор, а АКБ — это батарея аккумуляторов. Зачем так сделано? Не проще ли было сделать один большой аккумулятор?
Нет, не проще. Независимо от конструкции, размеров и принципа работы, все типы аккумуляторов дают напряжение около 2 вольт, в случае со свинцово-кислотными аккумуляторами напряжение составляет около 2,1 В. Понятно, что 12 В можно получить, если последовательно соединить сразу шесть таких аккумуляторов — это и делается в АКБ.
В нижней части каждой банки есть опорные призмы высотой несколько миллиметров, на которые опираются самые главные элементы АКБ — электродные блоки. Каждый блок состоит из ряда свинцовых пластин, разделенных тонкими прочными пластмассовыми пластинками — сепараторами.
Блок содержит четное количество пластин, одна их половина — отрицательные, другая — положительные. Пластины соединены друг с другом в своей верхней части прочной толстой перемычкой, которая также служит для выдержки определенного расстояния между пластинами.
Положительные и отрицательные пластины хотя и находятся рядом, но несколько отличаются друг от друга. В основе обеих пластин — свинцовая решетка, но ячейки положительных пластин заполнены двуокисью свинца (имеет темно-коричневый цвет), а ячейки отрицательных — губчатым свинцом (имеет серый цвет).
Электродные блоки жестко устанавливаются в банках, а банки, в свою очередь, закрываются герметичными крышками, в которые впаяны выводы электродов, и выполнены пробки для контроля электролита. Банки соединяются друг с другом посредством массивных свинцовых перемычек — борнов, расположенных на верхней крышке АКБ.
Сверху же монтируются и полюсные клеммы, к которым, собственно, и подключается бортовая электросеть автомобиля.
Так устроены аккумуляторы классической конструкции, а многие виды современных АКБ имеют несколько иные решения. В частности, распространены батареи с общей крышкой моноблока, обладающие меньшей габаритной высотой и лучшим соотношением массы к емкости.
Как аккумулятор запасает энергию
В корне неверно утверждение, что аккумулятор вырабатывает электричество — он его запасает во время заряда, и отдает во время разряда. А достигается эта цель с помощью ряда электрохимических реакций.
Наиболее просто описать процессы, происходящие внутри свинцово-кислотного аккумулятора, можно одной формулой:
Pb + PbO2 + H2SO4 ↔ PbSO4 + H2O
Эта реакция, как можно увидеть, обратимая, и во время разряда она протекает справа налево, а в время заряда — слева направо.
То есть, полностью заряженный аккумулятор представляет собой набор трех химических элементов — свинца, двуокиси свинца и серной кислоты (вода, которой разбавлена кислота, в реакции не принимает участия). При разряде и пористый свинец на отрицательных пластинах, и двуокись свинца на положительных реагирует с кислотой — в результате образуется сульфат свинца, который осаждается на отрицательных пластинах. Нетрудно понять, что во время разряда плотность электролита падает, ведь количество кислоты уменьшается, а количество воды — растет!
Нетрудно понять, что во время разряда плотность электролита падает, ведь количество кислоты уменьшается, а количество воды — растет!
Во время заряда реакция протекает в обратном направлении: из сульфата восстанавливается металлический свинец, а сернокислый остаток вступает в реакцию с водой, образуя серную кислоту. Так что при заряде кислоты становится больше, воды — меньше, а все это ведет к увеличению плотности электролита.
А чтобы эти реакции протекали с наибольшей интенсивностью, в конструкции АКБ имеется ряд особенностей. Главная из них — использование губчатого свинца — он пронизан тончайшими порами, и действительно похож на губку. Поры в десятки раз повышают площадь поверхности отрицательных электродов, что увеличивает интенсивность и эффективность течения реакций.
«Болезни» АКБ и попытки их «лечения»
В аккумуляторах используется свинец, но сам по себе этот металл обладает малой прочностью, поэтому на практике применяется легированный свинец повышенной прочности. Традиционно в качестве легирующей добавки выступает сурьма — ее содержание не превышает 5 — 7%. Однако применение сурьмы имеет не только положительный, но и отрицательный эффект.
Традиционно в качестве легирующей добавки выступает сурьма — ее содержание не превышает 5 — 7%. Однако применение сурьмы имеет не только положительный, но и отрицательный эффект.
Сурьма служит катализатором электрохимического разложения воды, и этот процесс запускается при меньшем напряжении, чем в отсутствии сурьмы. Ситуация усугубляется тем, что со временем сурьма осаждается на отрицательных электродах, и в какой-то момент из-за разложения воды электролит начинает «кипеть» не при полном заряде, а при гораздо более низких напряжениях. От такого АКБ уже не приходится ожидать нормальной работы. Кроме того, обильно выделяющийся газ делает батарею просто небезопасной в пожарном отношении — имели место случаи не просто пожаров, а взрывов таких аккумуляторов.
Данную проблему решают необслуживаемые аккумуляторы, в составе электродов которых нет или очень мало сурьмы (она заменена на другие металлы, в основном — на кальций). В этих АКБ электролит «закипает» только при полном заряде, и за короткое время не успевает выделиться большого количества газа. Нет электрохимического разложения воды — нет и истощения электролита, и именно это является главным преимуществом необслуживаемых АКБ.
Нет электрохимического разложения воды — нет и истощения электролита, и именно это является главным преимуществом необслуживаемых АКБ.
В данном виде аккумуляторов не предусмотрены пробки для контроля электролита — в них просто нет необходимости! Зачем следить за электролитом, если он не «кипит», и его плотность со временем остается постоянной? В остальном необслуживаемые АКБ устроены точно так же, как и АКБ классической конструкции.
Как видите, автомобильный аккумулятор устроен не слишком сложно, но это лишний раз подтверждает, что все гениальное — просто.
Какие химические вещества используются в аккумуляторах?
Для сборки батареи требуются определенные детали, состоящие из металлов и химикатов, которые влияют на стоимость батарей.
Давайте обсудим основные химические вещества, участвующие в производстве батареи:
a) Корпус батареи: Основная идея герметизации батареи корпусом батареи заключается в сохранении безопасности корпуса батареи, который является основным источником преобразования химической энергии в электрическую. Этот кожух изготавливается слоями, созданными из различного сырья, и может включать один или два, например, слоя полиэтилентерефталата, слоя полипропилена и слоя полимера или слоев карбонизированного пластика.
Этот кожух изготавливается слоями, созданными из различного сырья, и может включать один или два, например, слоя полиэтилентерефталата, слоя полипропилена и слоя полимера или слоев карбонизированного пластика.
b) Химический состав батареи: Чтобы выполнять свою основную функцию генерации тока для питания различных устройств, батарея должна содержать различные типы химической основы, которые различаются в зависимости от типа батареи:
и. Никель-кадмиевые батареи с использованием никеля и кадмия для длительного срока службы, расширенного температурного диапазона и высокой скорости разряда.
ii. Углеродно-цинковая батарея: Углеродно-цинковая батарея содержит диоксид марганца в качестве катода, цинк в качестве анода и хлорид цинка или хлорид аммония в качестве электролита.
iii. Свинцово-кислотные батареи: Свинцово-кислотные батареи содержат: диоксид свинца и металлический свинец в качестве анода и серную кислоту (электролит)
iv. Литий-ионные батареи: в батареях этого типа могут использоваться различные вещества, однако лучшая комбинация — это углерод в качестве анода и оксид лития-кобальта в качестве катода.
Литий-ионные батареи: в батареях этого типа могут использоваться различные вещества, однако лучшая комбинация — это углерод в качестве анода и оксид лития-кобальта в качестве катода.
v. Многоразовые щелочные батареи: анод представляет собой цинковый порошок, а катод — из смеси диоксида марганца. Батарея получила свое название от электролита гидроксида калия, который представляет собой растворимое вещество.
c) Электролит батареи: Электролит — это среда, которая позволяет электронам течь между двумя электродами (анодом и катодом). Электролит — это проводящий химикат, состоящий из соли, основания или кислоты, растворенных в растворителе, образуя раствор, который становится проводником электричества.Химические вещества, которые являются электролитами, включают: хлорид натрия, хлорную кислоту, азотную кислоту, нитрат калия, соляную кислоту, нитрат калия, серную кислоту, гидроксид натрия, гидроксид магния и ацетат натрия.
См.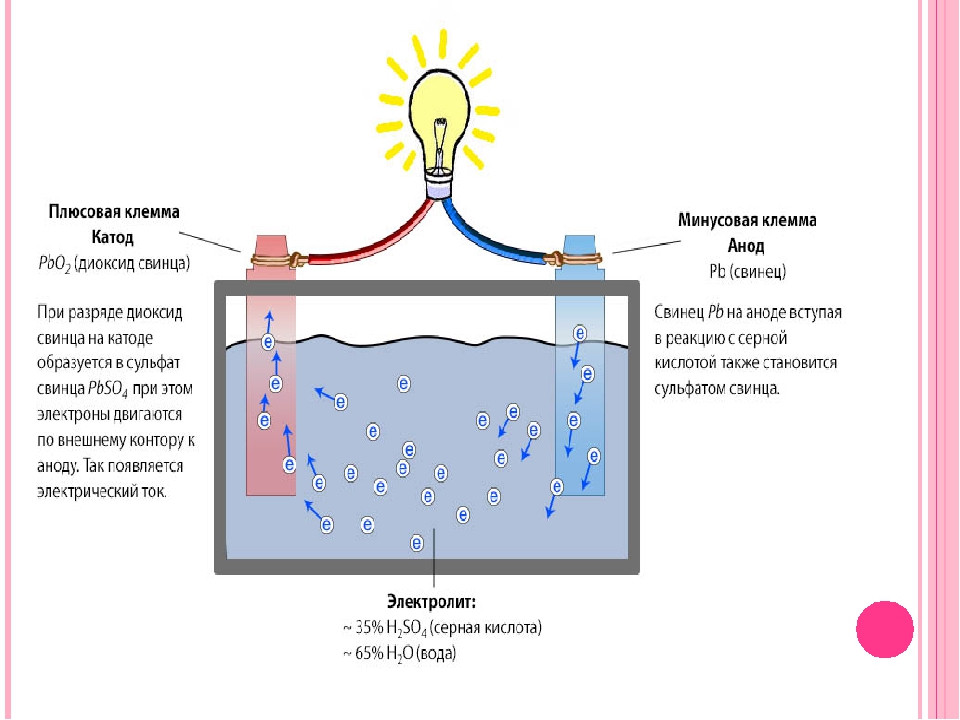 Также:
Также:
Металлы, используемые в батареях
Электролит батареи
Уголок вопросов: Аккумуляторная кислота — The Hindu
Почему в аккумуляторах используется только серная кислота? Почему не соляная кислота или азотная кислота?
ПРИЯНУЙ
Хокраджар, Ассам
Электрохимические реакции составляют основу преобразования химической энергии в электрическую в батареях.Электрохимическая реакция — это окислительно-восстановительная реакция, в которой участвующие электроны хитроумно направляются через внешнюю цепь, где они выполняют полезную работу.
Во время разряда батареи электроны, высвобождаемые на отрицательном электроде (катоде), проходят через внешнюю цепь и достигают положительного электрода (анода). Нейтральность заряда внутри батареи устанавливается движением ионов в электролите.
Таким образом, электролит должен быть хорошим проводником ионов.Электролит в батарее может участвовать или не участвовать в реакциях, происходящих на электродах, но должен поддерживать реакции. Например, электролит не участвует в клеточных реакциях в никель-кадмиевых и литий-ионных батареях.
Например, электролит не участвует в клеточных реакциях в никель-кадмиевых и литий-ионных батареях.
В случае сухих элементов из цинка и диоксида марганца можно использовать различные нейтральные / щелочные электролиты, такие как хлорид аммония, хлорид цинка и гидроксид калия.
В зависимости от используемых химикатов, цинково-марганцевый элемент с электролитом гидроксида калия может быть выполнен как первичный или вторичный.
При работе свинцово-кислотной батареи (обычно используемой для запуска-зажигания-зажигания в автомобилях) происходит образование сульфата свинца за счет окисления свинца на аноде и восстановления диоксида свинца на катоде.
Поскольку продуктом разряда батареи является сульфат свинца на обоих электродах, общую реакцию в элементе иногда называют реакцией двойного сульфата.
В образовании продуктов сульфата свинца участвует серная кислота, которая является электролитом, используемым в этих батареях.Во время зарядки аккумулятора сульфат свинца снова превращается в свинец и диоксид свинца, выделяя серную кислоту в электролит.
Поскольку серная кислота расходуется во время процесса разряда и высвобождается во время процесса заряда, удельный вес электролита изменяется во время использования и зарядки аккумулятора.
Следовательно, удельный вес электролита используется как индикатор степени заряда свинцово-кислотных аккумуляторов. Поскольку основные реакции в батарее включают поглощение и высвобождение молекул серной кислоты, в этих батареях используется электролит серной кислоты.
Однако можно использовать другие электролиты с парой свинец-диоксид свинца. Они включают хлорную кислоту, фторборную кислоту, кремнефтористоводородную кислоту и т. Д. Но проблемы с их использованием ограничивают их применимость в качестве электролитов. Например, хлорная кислота потенциально взрывоопасна при контакте с органическими веществами.
Т. ШРИ ДЭВИ КУМАРИ
CSIR-старший научный сотрудник
Отдел функциональных материалов
ЦНИИ-Центральный научно-исследовательский электрохимический институт
Караикуди, Тамил Наду
(копия исправлена из-за фактической ошибки)
Что такое аккумуляторная кислота?
Аккумуляторная кислота может относиться к любой кислоте, используемой в химическом элементе или аккумуляторе, но обычно этот термин описывает кислоту, используемую в свинцово-кислотных аккумуляторах, например, в автомобилях.
Кислота автомобильного или автомобильного аккумулятора — это 30-50% серная кислота (H 2 SO 4 ) в воде. Обычно кислота имеет мольную долю серной кислоты 29–32%, плотность 1,25–1,28 кг / л и концентрацию 4,2–5 моль / л. Аккумуляторная кислота имеет pH примерно 0,8.
Строительство и химическая реакция
Свинцово-кислотный аккумулятор состоит из двух свинцовых пластин, разделенных жидкостью или гелем, содержащим серную кислоту в воде. Батарея перезаряжаемая, с химическими реакциями зарядки и разрядки.Когда батарея используется (разряжена), электроны перемещаются от отрицательно заряженной свинцовой пластины к положительно заряженной.
Отрицательная реакция пластины:
Pb (s) + HSO 4 — (водн.) → PbSO 4 (s) + H + (водн.) + 2 e —
Положительная реакция пластины:
PbO 2 (т.) + HSO 4 — + 3H + (водн.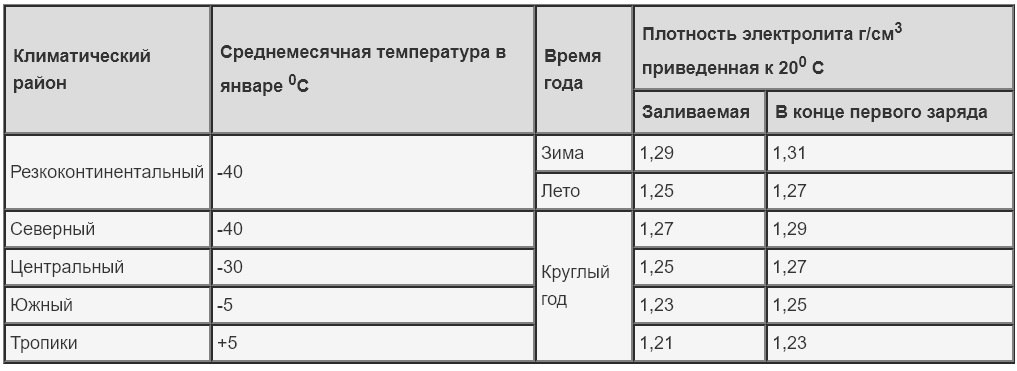 ) + 2 e — → PbSO 4 (т.
) + 2 e — → PbSO 4 (т.
Что можно объединить, чтобы записать общую химическую реакцию:
Pb (с) + PbO 2 (с) + 2 H 2 SO 4 (водн.) → 2 PbSO 4 (с) + 2 H 2 O (л)
Зарядка и разрядка
Когда аккумулятор полностью заряжен, отрицательная пластина — это свинец, электролит — концентрированная серная кислота, а положительная пластина — диоксид свинца.Если аккумулятор чрезмерно заряжен, при электролизе воды образуется газообразный водород и газообразный кислород, которые теряются. Некоторые типы батарей позволяют добавлять воду, чтобы восполнить потерю.
Когда аккумулятор разряжен, обратная реакция образует сульфат свинца на обеих пластинах. Если аккумулятор полностью разряжен, в результате образуются две идентичные пластины сульфата свинца, разделенные водой. На этом этапе аккумулятор считается полностью разряженным и не может восстановиться или снова зарядиться.
Что такое аккумуляторная кислота?
Аккумуляторная кислота обычно относится к кислоте, используемой в свинцово-кислотных аккумуляторах, хотя она необходима для функционирования любой кислотной аккумуляторной батареи или химического элемента.Хранение химической энергии для возможного использования в электричестве — это основной принцип, лежащий в основе батарей, в том числе для батарей, использующих кислоту.
Принцип действия этого электрохимического процесса во многом обусловлен особой структурой и химическим составом этих устройств, но аккумуляторная кислота также играет решающую роль.
Связано: Купить аккумуляторную кислоту онлайн Из чего состоит аккумуляторная кислота? Обычно относится к типу кислоты, используемой в перезаряжаемых свинцово-кислотных аккумуляторах, например, используемых в автомобилях, аккумуляторная кислота состоит из серной кислоты (H 2 SO 4 ), которая была разбавлена очищенной водой до концентрация около 30-50%. В этом контексте кислотный pH аккумуляторной кислоты составляет 0,8. Вот почему с ним нужно обращаться осторожно.
В этом контексте кислотный pH аккумуляторной кислоты составляет 0,8. Вот почему с ним нужно обращаться осторожно.
Свинцово-кислотные батареи состоят из двух проводящих свинцовых пластин, называемых электродами, которые заполнены вязким гелеобразным веществом. Между этими пластинами находится разбавленный раствор серной кислоты, также известный как электролит. Другой ключевой частью свинцово-кислотных аккумуляторов является разделитель, который служит изолятором, предотвращая прямое соприкосновение двух пластин друг с другом, что может привести к короткому замыканию.
Аккумуляторная кислота — это серная кислота, разбавленная очищенной водой. Что делает аккумуляторная кислота?Проще говоря, аккумуляторная кислота способствует преобразованию накопленной химической энергии в электрическую. Обычная батарея обычно состоит из трех основных частей:
- Отрицательный электрод , также известный как анод , который отправляет электроны во внешнюю цепь.
 Обычно это делается из губчатого свинца
Обычно это делается из губчатого свинца - Положительный электрод или катод , который принимает электроны от внешней цепи.Обычно это диоксид свинца
- Электролит , обеспечивающий ионную проводимость . Обычно это жидкий раствор растворителя и растворенных солей
Электрохимическая реакция, обеспечиваемая кислотой аккумулятора, позволяет стабильному току проходить через пары электродов, когда электричество входит в анод и выходит из катода.
Когда батарея разряжается или используется в качестве источника питания, серная кислота в электролите реорганизует свои ионы так, чтобы они были менее концентрированными и более похожими на H 2 O.При этом выделяется серия сульфатов, которые покрывают свинцовые пластины анода и катода. Это уменьшает область, в которой могут происходить дальнейшие электрохимические реакции. Эта площадь поверхности, постоянно выделяя ионы, будет становиться все меньше и меньше по мере того, как израсходуется больше ионов.
Батарея будет продолжать работать до тех пор, пока не перестанет подавать достаточно энергии из-за того, что ее электролит обеднен сульфат-ионами. Чтобы снова заработать, аккумулятор необходимо перезарядить — процесс, который, по сути, является обратной реакцией того, что мы только что описали.
В двух словах, зарядка батареи преобразует электрическую энергию в химическую энергию, а при использовании (или разрядке) батареи используется накопленная химическая энергия, преобразуя ее в электрическую энергию.
Почему батареи содержат кислоту?Батареи содержат кислоту, поскольку она играет важную роль в протекающей электрохимической реакции. Также называемый аккумуляторным электролитом, аккумуляторная кислота — это среда, которая переносит электрический ток между положительным и отрицательным электродами.
Однако, хотя для облегчения реакции аккумуляторам необходим электролит, это не обязательно должен быть разбавленный раствор серной кислоты. Электролиты в батареях могут быть растворителями, смешанными с растворенными кислотами или щелочами, а типичные батареи AA / AAA / D даже содержат твердые, а не жидкие электролиты.
Насколько сильна кислота в аккумуляторной батарее?Аккумуляторная кислота обычно имеет концентрацию около 15–35%, хотя ее крепость может достигать 50%. Любая концентрация серной кислоты в свинцово-кислотных аккумуляторах вызывает сильную коррозию.Неправильное обращение с этим химическим веществом может привести к необратимой слепоте, тяжелым ожогам, повреждению внутренних органов при проглатывании или даже смерти.
Аккумуляторная кислота также легко воспламеняется и может воспламениться под воздействием высокой температуры или давления. Наряду с этими особенностями стоит отметить уникальную химическую структуру аккумуляторной кислоты и то, как она вступает в реакцию с другими материалами, создавая электричество или накапливая химическую энергию.
Какова формула аккумуляторной кислоты?Аккумуляторная кислота не имеет определенной формулы, но обычно она состоит только из серной кислоты (H 2 SO 4 ) и воды (H 2 O) с приблизительным уровнем pH 0.8 при концентрации 4-5 моль / л.
Как работает батарея, электроны текут от отрицательно заряженной свинцовой пластины к положительно заряженной пластине из диоксида свинца. Это движение электронов приводит к тому, что сульфаты, высвобождаемые из аккумуляторной батареи, покрывают анод кислотой, которая высвобождает избыточные электроны в устройство и обратно на катод, тем самым облегчая электрический поток. Формула этой реакции:
Pb (s) + PbO 2 (s) + 2 H 2 SO 4 (вод.) → 2PbSO 4 (s) + 2H 2 O
Аккумулятор Кислота содержится в свинцово-кислотных аккумуляторах, которые обычно используются для питания отстойников в случае аварийного освещения Что происходит, когда аккумулятор используется?Что на самом деле происходит, когда батарея используется, так это то, что отрицательно заряженные ионы сульфата в кислоте батареи переходят на отрицательный электрод, т.е.е. анод. Здесь они высвобождают свой отрицательный заряд, в то время как остальные сульфат-ионы соединяются с электродом, образуя сульфат свинца. Этот процесс сменяется высвобождением избыточных электронов, выходящих из отрицательного электрода и обратно к положительному электроду, то есть катоду.
Это, однако, со временем снижает концентрацию электролита, поскольку в растворе кислоты образуется больше сульфата свинца и больше воды. Это происходит, когда водород отделяется от H 2 SO 4 и вступает в реакцию с диоксидом свинца на катоде, что увеличивает концентрацию воды, поскольку больше ионов SO 4 будет использоваться для покрытия электрода во время использования батареи. .Это будет происходить до тех пор, пока аккумуляторная кислота не станет все более и более разбавленной, что сделает ее менее способной к дальнейшим электрохимическим реакциям из-за недостатка ионов сульфата.
По сути, непрерывное движение ионов — это то, что создает стабильный ток в батареях. Когда кислород в пластине диоксида свинца реагирует с ионами водорода с образованием воды, а отделенный сульфат реагирует с другой пластиной с образованием большего количества сульфата свинца, остается более разбавленный раствор серной кислоты, который можно перезарядить путем реверсирования процесса. я.е. подавая в него электричество и преобразовывая его в накопленную химическую энергию.
Эти электрохимические реакции в батареях были бы невозможны без аккумуляторной кислоты. Однако по мере развития технологий появляются разные типы аккумуляторов, и необходимо пересмотреть технические аспекты работы обычных автомобильных аккумуляторов, чтобы позволить новаторам создавать больше функций для аккумуляторов с кислотой или без нее.
Как работает электролит? — Батарейный университет
Узнайте больше о катализаторе, который охватывает электроды батареи и обеспечивает поток электричества.
Электролит служит катализатором, чтобы сделать батарею проводящей, способствуя перемещению ионов от катода к аноду при зарядке и в обратном направлении при разряде.Ионы — это электрически заряженные атомы, которые потеряли или приобрели электроны. Электролит батареи состоит из растворимых солей, кислот или других оснований в жидком, гелеобразном и сухом форматах. Электролит также бывает в виде полимера, который используется в твердотельной батарее, твердой керамики и расплавленных солей, как в натрий-серной батарее.
В свинцовой кислоте используется серная кислота . При зарядке кислота становится более плотной, так как оксид свинца (PbO 2 ) образуется на положительной пластине, а затем превращается почти в воду при полном разряде.Удельный вес серной кислоты измеряется ареометром. (См. Также BU-903: Как измерить заряд). Свинцово-кислотные батареи бывают залитых и герметичных форматов, также известных как свинцово-кислотные батареи с регулируемым клапаном (VRLA) или необслуживаемые.
Серная кислота бесцветна с легким желто-зеленым оттенком, растворима в воде и обладает высокой коррозионной активностью. Обесцвечивание до коричневатого оттенка может быть вызвано ржавчиной в результате анодной коррозии или попаданием воды в аккумуляторный блок.
Свинцово-кислотные батареи бывают разной плотности (SG).В аккумуляторах глубокого цикла используется плотный электролит с удельной массой до 1,330 для достижения высокой удельной энергии, стартерные батареи имеют средний удельный вес около 1,265, а стационарные батареи имеют низкий удельный вес от примерно 1,225 до умеренной коррозии и способствуют долговечности. (См. BU-903: Как измерить заряд.).
Серная кислота находит широкое применение, а также содержится в очистителях канализации и различных чистящих средствах. Кроме того, он служит для переработки минерального сырья, обработки минералов, производства удобрений, нефтепереработки, обработки сточных вод и химического синтеза.
| ВНИМАНИЕ: | Серная кислота может вызвать серьезные повреждения при контакте с кожей и привести к необратимой слепоте при попадании в глаза. Проглатывание серной кислоты вызывает необратимые повреждения. |
Электролитом в NiCd является щелочной электролит (гидроксид калия) . Большинство никель-кадмиевых батарей имеют цилиндрическую форму, в которой несколько слоев положительных и отрицательных материалов намотаны в рулон желе.Версия NiCd для заливки используется в качестве судовой батареи в коммерческих самолетах и в системах ИБП, работающих в жарком и холодном климате, требующих частой езды на велосипеде. NiCd дороже свинцово-кислотной, но служит дольше.
NiMH использует тот же или аналогичный электролит, что и NiCd, который обычно представляет собой гидроксид калия. Электроды NiMH уникальны и состоят из никеля, кобальта, марганца, алюминия и редкоземельных металлов, которые также используются в Li-ion. NiMH доступен только в герметичных версиях.
Гидроксид калия — это неорганическое соединение с формулой КОН, обычно называемое едким калием. Электролит бесцветен и имеет множество промышленных применений, например, в качестве ингредиента в большинстве мягких и жидких мыл. КОН вреден при проглатывании.
В Li-ion используется жидкий, гелевый или сухой полимерный электролит. Жидкая версия представляет собой горючий органический, а не водный тип, раствор солей лития с органическими растворителями, подобными этиленкарбонату. Смешивание растворов с различными карбонатами обеспечивает более высокую проводимость и расширяет температурный диапазон.Могут быть добавлены другие соли, чтобы уменьшить газообразование и улучшить цикличность при высоких температурах.
Литий-ионный аккумулятор с гелеобразными электролитами содержит множество добавок для увеличения проводимости, так же как и литий-полимерный аккумулятор. Настоящий сухой полимер становится проводящим только при повышенных температурах, и эта батарея больше не используется в коммерческих целях. Добавки также вводятся для достижения долговечности и уникальных характеристик. Рецепт засекречен и у каждого производителя есть свой секретный соус. (См. Также BU-808b: Почему умирает литий-ионный аккумулятор?)
Электролит должен быть стабильным, но это не относится к литий-ионному аккумулятору.На аноде образуется пассивирующая пленка, которая называется твердым электролитом (SEI) . Этот слой отделяет анод от катода, но позволяет ионам проходить сквозь него подобно сепаратору. По сути, слой SEI должен формироваться, чтобы батарея могла работать. Пленка стабилизирует систему и продлевает срок службы литий-ионного аккумулятора, но это приводит к снижению емкости. На катоде также происходит окисление электролита, что постоянно снижает емкость. (См. Также BU-701: Как заправить батареи)
Чтобы пленки не становились слишком ограничивающими, добавки смешиваются с электролитом, который расходуется во время формирования слоя SEI.При проведении судебно-медицинской экспертизы отследить их присутствие сложно, а то и невозможно. При этом патентованные добавки являются коммерческой тайной, как их состав, так и используемое количество.
Хорошо известная добавка — виниленкарбонат (ВК). Это химическое вещество увеличивает срок службы литий-ионных аккумуляторов, особенно при более высоких температурах, и сохраняет внутреннее сопротивление на низком уровне по мере использования и старения. ВК также поддерживает стабильную пленку SEI на аноде без побочных эффектов окисления электролита на катоде (Аурбах и др.).Говорят, что академические и исследовательские сообщества отстают от производителей ячеек в знаниях и выборе добавок, отсюда и большой секрет. (См. Также «Добавки и их влияние на эффективность кулоновского цинкования» в документе BU-808b: Что вызывает гибель литий-ионных аккумуляторов?
Для большинства коммерческих литий-ионных аккумуляторов слой SEI разрушается при температуре ячейки 75–90 ° C (167–194 ° F). Тип элемента и состояние заряда (SoC) влияют на пробой при повышенной температуре. Может возникнуть самонагревание, которое может привести к тепловому выходу из-под контроля, если не охладиться должным образом.Лабораторные тесты, проведенные на ячейках 18650, показали, что такое тепловое явление может развиться в течение двух дней.
Воспламеняемость литий-ионного электролита является еще одной проблемой, и проводятся эксперименты по получению негорючих или восстановленных легковоспламеняющихся электролитов с помощью добавок или разработки неорганических ионных жидкостей. Также проводятся исследования по работе литий-ионных аккумуляторов при низких температурах. На момент написания ни один из этих электролитов не находился в широком коммерческом использовании.
Высыхание или медленное превращение жидкого электролита в твердую форму является еще одним явлением старения, которое снижает производительность литий-ионных аккумуляторов.«Когда жидкость уходит, батареи разряжены», — говорит Джефф Дан, специалист по литий-ионным батареям и профессор физики. Жидкость электролита — еще один показатель состояния, который относится ко всем химическим свойствам аккумуляторов.
Последнее обновление: 26 фев 2020
*** Пожалуйста, прочтите комментарии ***
Комментарии предназначены для «комментирования», открытого обсуждения среди посетителей сайта. Battery University отслеживает комментарии и понимает важность выражения точек зрения и мнений на общем форуме.Однако при общении необходимо использовать соответствующий язык, избегая спама и дискриминации.
Если у вас есть предложение или вы хотите сообщить об ошибке, воспользуйтесь формой «свяжитесь с нами» или напишите нам по адресу: [email protected]. Нам нравится получать от вас известия, но мы не можем ответить на все запросы. Мы рекомендуем размещать свой вопрос в разделах комментариев, чтобы Battery University Group (BUG) могла поделиться им.
Предыдущий урок Следующий урокИли перейти к другой артикуле
Батареи как источник питанияПолив свинцово-кислотного аккумулятора: основы
Так же, как вы не можете обойтись без воды, так же как и ваша батарея.Полив свинцово-кислотного аккумулятора — важный этап обслуживания, который нельзя пропустить. Это сохраняет вашу батарею в оптимальном состоянии и безопасно для ее использования. Несвоевременный полив свинцово-кислотной батареи может привести к серьезным повреждениям, но не всегда легко понять, когда лучше поливать батарею. Следуйте этим инструкциям по поливу свинцово-кислотной батареи.
Почему батареи нужно поливать
Свинцово-кислотные батареи состоят из плоских свинцовых пластин, погруженных в бассейн с электролитом.Электролит состоит из воды и серной кислоты. Размер пластин аккумулятора и количество электролита определяют количество заряда, которое может сохранить свинцово-кислотный аккумулятор, или количество часов использования. Вода — ключевая часть функционирования свинцовой батареи.
Кроме того, во время процесса перезарядки, когда электричество проходит через водную часть электролита, вода превращается в свои исходные элементы, водород и кислород. Эти газы очень легко воспламеняются, и поэтому из вашего жилого автофургона или морских аккумуляторов необходимо выпускать воздух наружу.Выделение газов приводит к потере воды, поэтому в свинцово-кислотные батареи необходимо периодически добавлять воду. Батареи, не требующие особого обслуживания, такие как батареи AGM, являются исключением, поскольку они способны компенсировать потерю воды.
Чрезмерный полив и недостаточный полив могут повредить аккумулятор. Чтобы свинцовый аккумулятор работал на максимальном уровне, следуйте этим рекомендациям по поливу.
Сначала — начните с безопасностиДля начала обязательно используйте средства индивидуальной защиты, такие как защитные очки и перчатки, при работе с аккумуляторами.Кроме того, очень важно понимать, что некоторые батареи требуют регулярного полива, в то время как другие батареи не требуют обслуживания.
Обязательно найдите информацию на этикетке аккумулятора, которая указывает, можно ли открыть аккумулятор и отремонтировать. В зависимости от типа батареи, которую вы используете, предупреждающие надписи на батарее должны направлять вас «НЕ ОТКРЫВАТЬ» батарею или «ЗАДЕРЖИВАЙТЕ ВЕНТИЛЯЦИОННЫЕ КОЛПАЧКИ ПОСЛЕ ПОЛИВА». Обязательно следуйте инструкциям на этикетке с предупреждением.
Как полить аккумулятор
Хотя аккумулятор следует заряжать только после того, как он полностью зарядится, вам также следует проверить уровень воды перед зарядкой, чтобы убедиться, что воды достаточно, чтобы покрыть все открытые пластины. После зарядки добавьте достаточно воды, чтобы довести уровень до дна вентиляционного отверстия, примерно на ¾ ниже верха элемента.
Важно отметить, что владельцы аккумуляторов никогда не должны добавлять в аккумуляторы серную кислоту. При нормальной работе батареи потребляют только воду, а не серную кислоту.Когда уровень электролита в аккумуляторе низкий, заполнение аккумулятора водой сохранит аккумулятор здоровым и безопасным для использования.
Не над водойВо время зарядки аккумулятора плотность раствора электролита увеличивается. Если перед зарядкой было добавлено слишком много воды, уровень электролита увеличится, что приведет к переполнению аккумулятора и повреждению аккумулятора. Кроме того, чрезмерный полив аккумулятора может привести к дополнительному разбавлению электролита, что приведет к снижению производительности аккумулятора.
Когда следует поливать аккумулятор
Как часто вы добавляете воду в аккумулятор, зависит от того, как часто вы им пользуетесь. Аккумулятор для тележки для гольфа, который используется только по выходным, может потребовать полива только один раз в месяц. Вилочный погрузчик, который используется весь день, каждый день, может нуждаться в поливе аккумулятора каждую неделю. В жаркую погоду увеличивается потребность в поливе. Важно регулярно проверять уровень жидкости в аккумуляторе — лучше всего это делать после того, как аккумулятор зарядится.
Какую воду следует использоватьИзбегайте использования водопроводной воды. При заправке аккумулятора обычная водопроводная вода не подойдет. Водопроводная вода содержит минералы, которые вредны для аккумуляторов, даже если их добавляют в небольших количествах. Это особенно верно для воды, умягченной с помощью умягчителей, содержащих хлориды. На всякий случай лучше всего подойдет дистиллированная вода, которая требует гораздо меньших вложений, чем новая батарея.
Помните, что вода будет находиться поверх раствора кислоты в вашей батарее, пока он не смешается с пузырьками, возникающими при зарядке.Если вы снимаете показания ареометра электролита, лучше всего снимать их после завершения зарядки.
Не допускайте обезвоживания аккумулятора. Поливайте в жаркие месяцы и круглый год.
Свинцовая аккумуляторная батарея | Введение в химию
Цель обучения
- Вспомните химическую реакцию, которая происходит в свинцовых аккумуляторных батареях
Ключевые моменты
- Свинцово-кислотные батареи, также известные как свинцовые аккумуляторные батареи, могут накапливать большой заряд и обеспечивать высокий ток в течение коротких периодов времени.
- Базовая конструкция свинцово-кислотных аккумуляторов не претерпела значительных изменений с 1859 года, когда их спроектировал Планте, хотя некоторые улучшения были внесены Фор.
- Свинцово-кислотные аккумуляторы можно заряжать, что важно при их использовании в автомобилях.
- Разрядка накопленной энергии зависит от того, как положительная, так и отрицательная пластины превращаются в сульфат свинца (II), а электролит теряет большую часть растворенной серной кислоты.
Срок
- лигносульфонат Водорастворимые анионные полиэлектролитные полимеры; они являются побочными продуктами производства древесной массы с использованием сульфитной варки.
Свинцовые батареи
Свинцовая аккумуляторная батарея, также известная как свинцово-кислотная батарея, является самым старым типом аккумуляторных батарей и одним из наиболее распространенных устройств хранения энергии. Эти батареи были изобретены в 1859 году французским физиком Гастоном Планте, и они до сих пор используются во множестве приложений. Большинство людей привыкло использовать их в транспортных средствах, где они могут обеспечивать высокие токи для запуска двигателя.
Хотя батареи надежны, их срок службы ограничен, они тяжелы при транспортировке и содержат токсичные материалы, которые требуют специальных методов удаления по окончании срока службы.Свинцово-кислотные батареи имеют умеренную удельную мощность и хорошее время отклика. В зависимости от используемой технологии преобразования энергии батареи могут перейти от приема энергии к мгновенной подаче энергии. Свинцово-кислотные аккумуляторы подвержены влиянию температуры и должны поддерживаться в надлежащем состоянии для достижения максимального срока службы.
Разработка свинцовой батареи
В конструкции свинцово-кислотного элемента Планте положительная и отрицательная пластины были сделаны из двух спиралей свинцовой фольги, разделенных листом ткани и скрученных.Ячейки изначально были малой вместимостью. Требовался медленный процесс «формовки» для коррозии свинцовой фольги, образования диоксида свинца на пластинах и придания им шероховатости для увеличения площади поверхности. Пластины Планте все еще используются в некоторых стационарных приложениях, где на пластинах имеются механические канавки для увеличения площади поверхности.
Свинцовая аккумуляторная батарея Схема, показывающая, как свинцовая аккумуляторная батарея состоит из шести последовательно соединенных двухвольтовых элементов. Также показан состав каждой ячейки.Конструкция из клееных пластин Камиллы Альфонса Фор типична для современных автомобильных аккумуляторов.Каждая пластина состоит из прямоугольной свинцовой сетки. Отверстия решетки заполнены пастой из красного свинца и 33-процентной разбавленной серной кислоты. Эта пористая паста позволяет кислоте реагировать со свинцом внутри пластины, что увеличивает площадь поверхности. После высыхания пластины складываются с помощью подходящих разделителей и вставляются в аккумуляторный контейнер. Обычно используется нечетное количество пластин, на одну отрицательную пластину больше, чем положительной. Каждая альтернативная пластина подключается.
Паста содержит технический углерод, сульфат бария и лигносульфонат.Сульфат бария действует как затравочный кристалл для реакции сульфата свинца в свинец. Лигносульфонат предотвращает образование твердой массы отрицательной пластиной во время цикла разряда, а вместо этого позволяет образовывать длинные игольчатые кристаллы. Технический углерод противодействует эффекту ингибирования образования, вызванному лигносульфонатами.
Разрядная химия
В разряженном состоянии как положительная, так и отрицательная пластины становятся сульфатом свинца (II) (PbSO 4 ). Электролит теряет большую часть растворенной серной кислоты и превращается в основном в воду.Процесс разряда управляется проводимостью электронов от отрицательной пластины обратно в ячейку на положительной пластине во внешней цепи.
Отрицательная реакция пластины: Pb (s) + HSO 4 — (вод.) → PbSO 4 (s) + H + (вод.) + 2e —
Положительная реакция пластины: PbO 2 (s) + HSO 4 — (водный) + 3H + (водный) + 2e — → PbSO 4 (s) + 2H 2 O (л)
Комбинируя эти две реакции, можно определить общую реакцию:
Pb (с) + PbO 2 (с) + 2H + (вод.) + 2HSO 4 — (водн.) → 2PbSO 4 (с) + 2H 2 O (л)
Зарядная химия
Аккумулятор этого типа можно заряжать.В заряженном состоянии каждая ячейка содержит отрицательные пластины из элементарного свинца (Pb) и положительные пластины из оксида свинца (IV) (PbO 2 ) в электролите примерно 4,2 М серной кислоты (H 2 SO 4 ). . Процесс зарядки осуществляется за счет принудительного удаления электронов с положительной пластины и принудительного введения их в отрицательную пластину источником заряда.
Отрицательная реакция пластины: PbSO 4 (т.
Положительная реакция пластины: PbSO 4 (с) + 2H 2 O (л) → PbO 2 (с) + HSO 4 — (водный) + 3H + (водный) + 2e –
Объединение этих двух реакций дает полную реакцию, обратную реакции разряда:
2PbSO 4 (с) + 2H 2 O (л) → Pb (с) + PbO 2 (с) + 2H + (вод.


 д.
д. 31
31 329
329 30
30 .. +35
.. +35 е. с добавкой едкого лития
е. с добавкой едкого лития

 Обычно это делается из губчатого свинца
Обычно это делается из губчатого свинца