Электролит – это токопроводящая жидкость, которая представляет собой смесь дистиллированной воды и кислоты или щелочи. Подробнее о свойствах и видах электролита можно почитать в нашей прошлой статье.
Сейчас мы хотим уделить внимание первому виду этого раствора – кислотному электролиту
Состав и изготовление
Важно понимать, что при нарушении технологии изготовления раствора щелочи или серной кислоты ваш аккумулятор может выйти из строя. Поэтому многие предпочитают покупать кислотную или щелочную смесь в специализированных магазинах.
Если вы решились приготовить токопроводящую жидкость самостоятельно, то для кислотного электролита вам понадобятся дистиллированная вода и серная кислота.
Преимущества серной кислоты заключаются в том, что она почти не имеет запаха и не испаряется при нормальной комнатной температуре от 15 до 25 градусов тепла. Также по другим химическим характеристикам это вещество лучшим образом подходит для заливки в АКБ со свинцовыми пластинами.
Правила безопасности и свойства:
Плотность является главным свойством электролита, ее значение может колебаться в зависимости от уровня заряда АКБ, но при нормальных условиях всегда должно оставаться внутри интервала от 1,26 до 1,30 г/мм^3
Нельзя забывать о том, что серная кислота – это едкое вещество. Поэтому работа с ней предполагает применение защитных средств. Как минимум, перчаток и защитных очков.
Как найти хороший автомобильный аккумулятор?
В Нижнем Новгороде вы можете купить аккумулятор недорого и быстро, просто зайдя в наш интернет магазин «Центр-АКБ». В каталоге магазина представлены различные модели с подробными техническими характеристиками. Поэтому, если вы решились купить аккумулятор Bosch или батареи других брендов, смело заполняйте заявку на сайте или звоните по телефону горячей линии:+7 (831) 416-13-13
Нас можно найти в Нижнем Новгороде по адресам:
ул. Березовская, д. 96А
ул. Деловая, д. 7к5
проспект Кирова, 12
ул. Русская улица, 5
Какую кислоту заливают в аккумулятор автомобиля
Аккумулятор считается расходным элементом оснащения автомобиля. То есть АКБ имеет определённый срок службы, по завершению которого батарею меняют на новую.

Но установленный производителем срок не все АКБ проживают в полной мере. Довольно часто ресурс может сократиться в несколько раз. Причём тут вина может быть не только в низком качестве АКБ, но и в неправильных действиях со стороны автовладельца, занимающегося обслуживанием.
Обслуживание АКБ предусматривает периодическую зарядку и доливку специальной жидкости, которую называют электролитом. При этом не все понимают, о каком составе идёт речь, что в него входит. Электролитом называют смесь из кислоты и дистиллированной воды. Следует детальнее разобраться в составе смеси и главном применяемом компоненте, то есть в кислоте.
Для чего применяют кислоту
Для лучшего понимания ситуации АКБ, используемые в автомобилях, можно представить как обычные батарейки. То есть она состоит из катода, анода и аккумуляторной жидкости. Она же электролит.
Состав электролита довольно простой. Это кислота и дистиллированная вода. Их смешивают в определённых пропорциях. Дабы понять функции кислоты, нужно взглянуть на протекающие внутри АКБ процессы, которые наблюдаются во время заряда и разряда устройства.
Кислота необходима для того, чтобы обеспечивать появление тока. Кислота взаимодействует с металлами и оксидами, то есть происходит химическая реакция, что и позволяет АКБ работать.
Когда на АКБ воздействует внешняя нагрузка от генератора или зарядного устройства, жидкость реагирует со свинцом и оксидами, тем самым протекает окислительно-восстановительный процесс. Причём этот процесс будет противоположным при заряде и разряде АКБ.
Ток образуется из-за того, что начинают выделяться положительные электроны свинца, из которого выполнены пластины, а также из-за получения оксидов от отрицательных пластин. Передача заряженных частиц возможна именно за счёт применяемого электролита.
Контакты, расположенные в батарее, сталкиваются с несколькими протекающими процессами:
- расход триоксида серы;
- восстановление оксидов свинца на катоде;
- выделение воды;
- образование окиси металла на аноде.
Когда возникает реакция, происходит замещение кислоты водой. Это способствует снижению плотности электролита. Если идёт процесс заряда, реакции протекают в обратном направлении. Ток стимулирует электролиз, и жидкость распадается на составляющие компоненты. В случае с водой это водород и кислород. Выделения происходят в виде газа. Затем электролит начинает кипеть. Вещество выходит из жидкого агрегатного состояния, но обратно не возвращается. Это способствует увеличению плотности, поскольку количество воды снижается, а концентрация кислоты увеличивается. Для восстановления правильных параметров нужно выровнять процентное соотношение воды и кислоты. Для этого в АКБ добавляют дистиллированную воду.
Добавлять в батарею обычную водопроводную воду ни в коем случае нельзя. В ней содержится много примесей, которые приведут к быстрому выходу из строя АКБ.
Но пока не удалось получить ответ на главный вопрос, касающийся применяемой кислоты.
Используемый вид кислоты
Автомобилистов закономерно интересует, какие кислоты используются в аккумуляторах автомобилей. В действительности существуют разные варианты и догадки на этот счёт.
Некоторые уверены, что здесь применяется только соляная кислота. Другие делают ставки на серную.

Поэтому важно ответить, какая именно кислота находится в аккумуляторе, серная или же соляная.
Запомните раз и навсегда. В АКБ применяют только серную кислоту.
Если вас когда-то спросят, какая кислота всегда находится в аккумуляторе, смело отвечайте, что серная. Но никак не соляная. Это распространённое заблуждение.
Также будет полезно знать, как ещё называется кислота, используемая в аккумуляторе. Да, чаще всего её называют просто серной. Но есть и другое название. А именно триоксид серы или ангидрид серы. Сами понимаете, что понятие серной кислоты запомнить намного проще.
Определившись с тем, какая кислота всегда заливается в автомобильный аккумулятор, можно рассказать о ней некоторые подробности, а также взглянуть на особенности готового к использованию электролита.
Вообще различают несколько видов аккумуляторов, и не всегда есть смысл спрашивать, какую кислоту в их случае добавляют, поскольку аккумулятор определённого типа не предусматривает её применение. Это те же литиевые АКБ и никель-кадмиевые. В последнем случае вместо кислоты применяется щёлочь.
Несколько иначе обстоят дела с гелевыми АКБ. Если говорить о том, какую кислоту всегда добавляют в такой аккумулятор, то тут ответ будет аналогичным. Кислота там серная. Только находится электролит в гелеобразном состоянии.
Подавляющее большинство АКБ, применяемых в авто, являются свинцово-кислотными. Они делятся на несколько разновидностей, в зависимости от добавок и агрегатного состояния электролита. Но практически всегда речь идёт именно о кислотных устройствах. И вы теперь знаете, какая кислота применяется в АКБ.
Пропорции раствора примерно всегда одинаковые. Это от 30 до 35% кислоты, всё остальное занимает вода.
Крайне редко процентное соотношение превышает 35 на 65%. Чтобы выполнять все задачи, поставленные перед автомобильными АКБ, вполне достаточно и 30%.
Теперь вы знаете, какая именно кислота всегда находится в автомобильном аккумуляторе. Это позволит понять, что необходимо покупать для последующего обслуживания.
Смысл обслуживания заключается в том, чтобы добавлять определённое количество готового электролита либо же только дистиллированную воду.
Но объективно мало просто понимать, какая кислота обычно при производстве используется в аккумуляторе того или иного автомобиля. Предстоит ещё немного разобраться с понятиями концентрации и плотности.
Параметры плотности и концентрации
Концентрация является соотношением между объёмом используемой дистиллированной воды и кислоты. Чтобы автомобилистам не приходилось изготавливать состав своими руками, дабы аккумуляторная кислота не нанесли вред коже или слизистым оболочкам при смешивании, в продаже доступен уже готовый к использованию раствор. Он так и называется электролитом.
Но концентрация не играет столь важной роли, как показатели плотности.
Плотность в нормальном состоянии варьируется в пределах от 1,07 до 1,3. Измеряется в г/см3. При изменении этих значений меняется температура замерзания состава.
От плотности зависит и эффективность проводимости электричества, которая обратно пропорциональна сопротивлению. Если авто будет эксплуатироваться при низких температурах окружающей среды, плотность следует поднять ближе к отметке 1,3 г/см3. Для российского климата нормальным значением принято считать 1,27-1,28 г/см3.
Если говорить об электропроводимости, то плотность, составляющая 1,3 г/см3, будет негативно на неё влиять. Это слишком высокая плотность. Но если её снизить, а температура окружающей среды окажется очень низкой, тогда состав попросту замёрзнет. А это потенциальная угроза для разрыва банок АКБ и разгерметизации корпуса, что ведёт за собой полную замену устройства.
В продаже доступны электролиты, обладающие разными параметрами плотности. Это напрямую связано с сезоном, для которого используется рабочая жидкость. Чем холоднее, тем выше должна быть плотность.
Если использовать подходящую смесь на основе серной кислоты и дистиллированной воды, это позволит значительно продлить срок службы аккумулятора.
Как контролировать состояние АКБ
Перед автомобилистом стоит важнейшая задача. Ему требуется постоянно контролировать состояние АКБ, следить за уровнем рабочей жидкости, её плотностью и концентрацией.
Всё это возможно контролировать и влиять на параметры при использовании кислотно-свинцовой обслуживаемой батареи.
Если АКБ необслуживаемая, добавить воду или залить недостающее количество электролита не получится. Некоторые идут на ухищрения, делают небольшие отверстия, и используют медицинские шприцы. Но это потенциально очень опасно и заниматься подобным восстановлением работоспособности необслуживаемых АКБ настоятельно не рекомендуется.
Когда же АКБ обслуживаемая, контролировать уровень и плотность не составит большого труда. Для проверки уровня нужно:
- открутить пробки на банках;
- взять трубочку из стекла или прозрачного пластика;
- погрузить инструмент в АКБ до пластин;
- зажать верхнее отверстие трубочки пальцем;
- поднять приспособление;
- измерить, на каком уровне находится рабочая жидкость.
Нормой принято считать значение в пределах от 10 до 15 мм. Важно учесть, что на многих АКБ предусмотрены специальные метки, по которым довольно легко проверить уровень.
Если уровень отличается от нормального, тогда потребуется выполнить процедуру по доливке электролита либо же только дистиллированной воды. Это уже зависит от того, что покажут замеры плотности.
При измерении плотности не обойтись без такого прибора как ареометр. Он погружается во все банки аккумулятора, проверяются параметры в каждой из них. Если плотность выше рекомендуемых значений, состав следует разбавить дистиллированной водой. Если плотность ниже нормы, тогда заливается электролит.
Сколько служит электролит
Автомобилисты активно спорят на тему того, как долго сохраняет свои свойства электролит и есть ли у него ограничения по сроку службы.
У электролита отсутствует понятие конкретного срока службы. Это зависит от того, насколько эффективно жидкость выполняет свои задачи.
Пока смесь из дистиллированной воды и серной кислоты справляется со своими обязанностями, её считают пригодной к использованию.
На уменьшение или увеличение срока службы могут влиять такие факторы:
- плотность;
- температура эксплуатации АКБ;
- степень заряда батареи.
Если плотность будет в пределах нормы, батарея находится в состоянии полного или близкого к нему заряда, а также автомобилист не столкнётся с экстремально высокими или низкими температурами, на одном и том же электролите удастся ездить достаточно долго. Поскольку производитель предусматривает, что батареи служат от 5 до 8 лет, то и длительность работоспособности электролита примерно такая же. Но когда ресурс АКБ подходит к концу, это связано с разрушением пластин и с тем, что они не могут выполнять свои функции. Дело вовсе не в самом электролите. При условии исправных пластин жидкость может служить очень долго.
Ситуация с кислотно-свинцовыми АКБ не совсем простая. За ними нужен тщательный уход и постоянный контроль. Значимость аккумулятора переоценить сложно. Поэтому крайне важно изначально выбрать батарею высокого качества, соответствующую требованиям вашего автомобиля, а также поддерживать её в стабильном рабочем состоянии. В этом плане необслуживаемые АКБ проще. В них не требуется доливать электролит и дистиллированную воду. Единственным мероприятием может стать периодическая зарядка, если заряд аккумулятора не удаётся компенсировать естественным путём, за счёт работы генератора.
Какая кислота в аккумуляторе автомобиля?
Многие неопытные автомобилисты интересуются: какая кислота в аккумуляторе автомобиля – серная или соляная?
Название и роль кислоты
Основными жидкими веществами внутри аккумулятора являются:
- серная кислота – ее концентрация в стандартной АКБ составляет около трети объема;
- дистиллированная вода – она составляет около 70%.
Обычную воду использовать нельзя, т.к. в ней много солей и разных примесей. Здесь годится только очищенная вода – дистиллированная.
Основные процессы при разряде
Работа АКБ основывается на химических процессах в жидкости. В ней находятся пластины с разным зарядом. На решетках положительных электродов находится диоксид свинца. В процессе работы автомобиля, когда работающие на электричестве механизмы активно расходуют энергию, состояние электролита внутри батареи меняется, плотность жидкости падает.
Плотность электролита в кислотно-свинцовой АКБ меняется в зависимости от степени заряженности батареи. У серной кислоты нужной концентрации этот показатель составляет 1,83 г/см3, у электролита в заряженной батарее – 1,27-1,29 г/см3. В процессе работы автомобиля, когда идет расходование электроэнергии, концентрация снижается. Уменьшается общий уровень жидкости, она становится «плотнее». Требуется периодически доливать дистиллированную воду.
Изменение плотности раствора
Есть 2 варианта, как проводить обслуживание АКБ при изменении этих показателей. Если среднее значение плотности по всем банкам составляет не ниже 1,2 г/см3, то можно постепенно долить дистиллированной воды. Для каждой банки выполняются следующие действия:
- откачивается жидкость;
- заливается раствор с нужными характеристиками наполовину объема;
- чтобы все перемешалось, можно дать нагрузку на контактах, либо просто подождать;
- измерить основные параметры, если ничего не изменилось – то залить еще жидкости;
- перемешать и снова измерить;
- довести характеристики до требуемых значений.
А если плотность ниже 1,2 во всех банках, то придется полностью менять электролит.
Заливку нужно делать при помощи специальных трубок – полиэтиленовых или стеклянных. Уровень кислоты и воды должен быть не более 15 мм выше свинцовых пластин. После доливки аккумулятору надо дать постоять несколько часов, после чего снова проверить состояние и поставить на зарядку.
Характеристики электролита
Существуют разные мнения о том, каким должен быть предпочтительный период эксплуатации раствора. Это зависит от разных факторов:
- физических и химических характеристик;
- температуры, при которой эксплуатируется машина;
- уровня заряда аккумулятора.
Проверять состояние батареи внутри нужно не реже одного раза в полгода – в конце осени и в конце весны. Для этого надо:
- снять с машины;
- открутить пробки;
- в одну банку опустить конец ареометра;
- при помощи груши втянуть раствор;
- провести замер.
Если все эти параметры поддерживать в нужных значениях, то тогда раствор будет служить достаточно долго.

 Практически на всем протяжении эксплуатации автомобильной техники, водители сталкиваются с таким понятием как уровень и плотность электролита в аккумуляторе. Обслуживаемые батареи до сих пор в большинстве случаев вытесняют свои аналоги по некоторым техническим параметрам, одним и таких параметров является диапазон рабочих температур.
Практически на всем протяжении эксплуатации автомобильной техники, водители сталкиваются с таким понятием как уровень и плотность электролита в аккумуляторе. Обслуживаемые батареи до сих пор в большинстве случаев вытесняют свои аналоги по некоторым техническим параметрам, одним и таких параметров является диапазон рабочих температур.
Электролит для аккумуляторов
Жидкость для аккумуляторов представляет собой особый раствор из активных веществ необходимый для накопления и удержания внутренней энергии источника питания. От состава такого электропроводника зависит нормальная работа батареи, а также срок службы, который измеряется количеством циклов заряд-разряд. Непосредственно в самом растворе для АКБ происходит преобразование химической реакции в электричество в процессе зарядки. Многие современные источники питания работают на жидких электролитах.
Для обеспечения питания автомобильной техники применяются два основных вида электролита:
- щелочной;
- кислотный.
Основным минусом таких батарей является необходимость систематического осмотра и добавления дистиллированной воды в банки. Применять следует только качественные материалы иначе источник питания может выйти из строя.
Важно! Использование в аккумуляторе обычной воды приводит к осыпанию пластин и выходу батареи из строя.
Электролит кислотный
Самым распространенным раствором, применяемым в автомобильных источниках, питания является кислотный. Такая специальная жидкость состоит из двух элементов:
- дистиллированная вода;
- кислота.
Для кислотных аккумуляторов есть одна особенность, их необходимо постоянно обслуживать, доливать кислоту или воду. Такие меры следует выполнять из-за испарения электролита в режиме эксплуатации, либо заряда.
Интересно знать! Плотность и уровень электролита являются основными показателями, за которыми необходимо постоянно следить.
Аккумуляторная кислота
В качестве кислотной составляющей применяется раствор на основе серы (серная кислота). Такое вещество является очень опасным и может привести к химическим ожогам при попадании на кожные покровы или слизистую.
Серная кислота представляет собой маслянистую жидкость без цвета. Она хорошо растворяется в воде, при этом может выделяться значительное количество тепла. При нормальной температуре и без посторонних примесей имеет плотность 1,830 г/см3. Однако примеси все же могут содержаться в составе раствора, в нем могут находиться мышьяка, марганец, хлор и железо.
Дистиллированная вода
В процессе приготовления электролита необходимо применять очищенную от примесей воду. Категорически запрещается использовать водопроводную и речную, это приведет к необратимым реакциям в источнике питания. Допускается добавлять в раствор конденсат, образующийся в котельных установках повышенной мощности.
Для промышленного изготовления дистиллированной воды применяют специальные электрические дистилляторы. Установка мощностью 4 кВт имеет производительность до пяти литров в час.
Совет! Перед применением воды после очистки необходимо проверить содержание посторонних примесей в ней.
Основные соотношения составляющих
Для приготовления электролита необходимой концентрации необходимо руководствоваться следующими рекомендациями при подборе пропорций вещества:
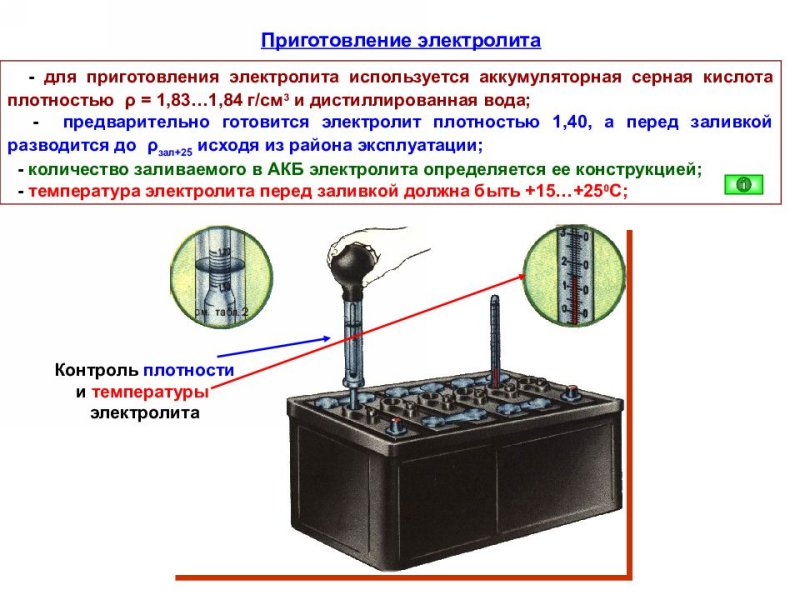
Для того, чтобы приготовить жидкость плотностью 1,4 г/см3 необходимо соблюдать пропорции в таблице:
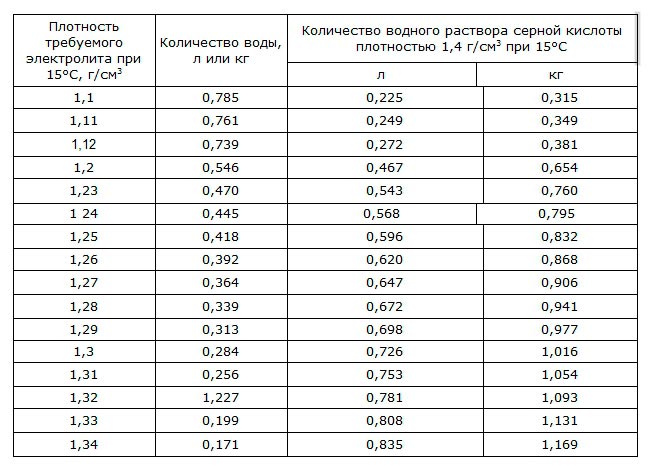

Изготовление раствора из кислоты плотностью 1,83 г/см3 рекомендуется по следующим пропорциям:
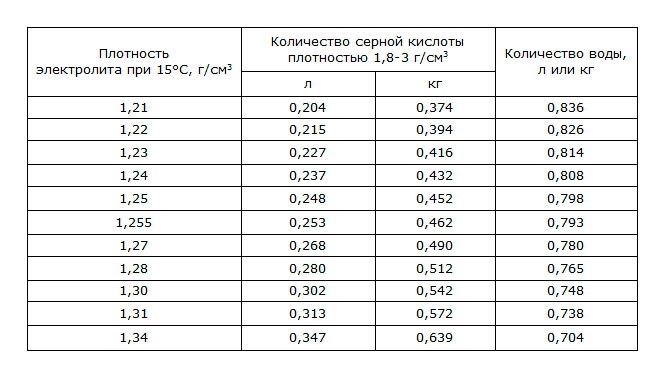

Существует еще один необходимый параметр, который следует учитывать это уменьшение количества изготовленного раствора кислоты и воды при понижении температуры. Для контроля за этим свойством создана таблица сокращения количества раствора:

Вязкость
В процессе эксплуатации аккумуляторной батареи в каждой банке протекают химические реакции. Скорость взаимодействия напрямую зависит от вязкости электролита. Данный параметр характеризует процессы диффузии при разряде и заряде батареи. При повышении вязкости снижаются скорости реакций в электролите, происходит уменьшение внутренней емкости аккумулятора. Пониженная температура пагубно влияет на показания этого параметра, поэтому при установке источника питания следует учитывать это условие.
Удельное сопротивление
При полезных свойствах проводимости электролит имеет и характеристику сопротивления. Она рассчитывается по формуле:
R= r*S/L,
где r — это внутренне удельное сопротивление источника питания;
S- это поперечное сечение проводника;
L- это длина проводника.
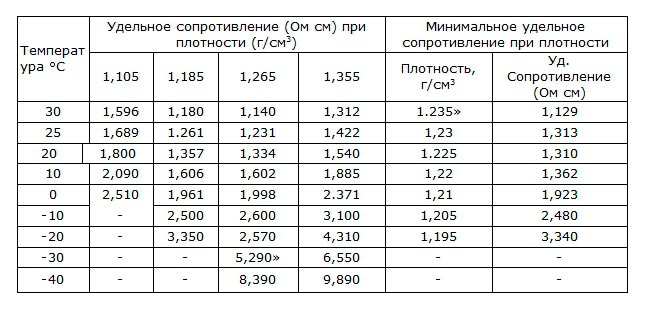

Значение удельного сопротивления обратно пропорционально показаниям температуры окружающей среды.
Для сохранения широкого диапазона рабочих температур повышают плотность электролита. В таблице указана температура замерзания электролита в аккумуляторе:
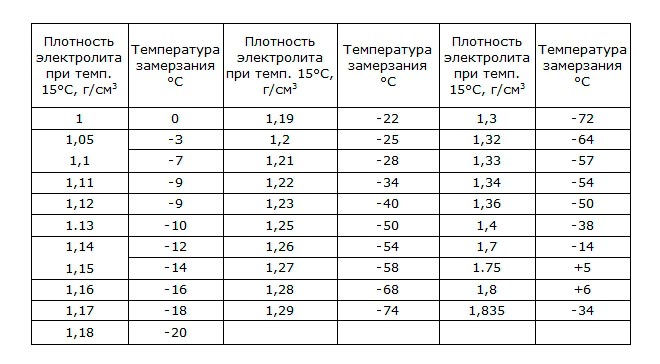

Внимание! В современные пусковые аккумуляторы заливают проводниковый раствор значением плотности 1,3 г/см3, это позволяет сохранить полезные свойства в суровых условиях эксплуатации, а также продлить срок годности.
Щелочной электролит
Состоит данный электролит из щелочной составляющей и дистиллированной воды. Щелочь представляет собой соединения на основе калия (КОН) или лития.
КОН- твердое вещество белого цвета, полностью растворяется в воде при этом выделяется тепло. Электролит для щелочных аккумуляторов изготавливают трех видов:
- высший, с содержанием КОН до 96%;
- категории А до 92%;
- категория В до 88%.
Внимание! В процессе производства щелочного электролита необходимо соблюдать меры предосторожности, так как едкий калий является опасным веществом.
Рекомендуемая плотность для АКБ указывается в паспорте источника питания при изготовлении. Производители при нормальном режиме работы заливают электролит со значением 1,21 г/см3, в зимний период концентрация щелочи в нем прибавляется до значения 1,27 г/см3.
Плотность щелочного электролита указана в таблице:
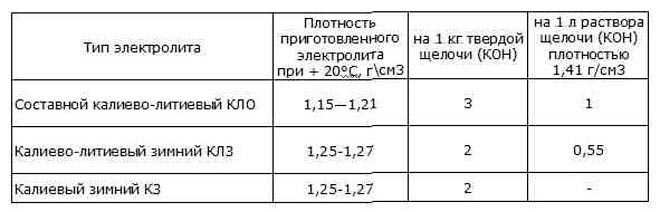

Утилизация электролита
При выходе из строя источника питания необходимо заменить его на новый. Тогда возникает вопрос, а куда деть старый. В настоящее время существует большое число пунктов приема и утилизации отработавших аккумуляторов. Специальные станции переработки электролита нейтрализуют вредные вещества в нем, при этом оберегая окружающую среду от опасности загрязнения.
Изготовление электролита самостоятельно это трудоемкий и опасный процесс, поэтому целесообразнее будет приобрести готовый в магазине. Заводская жидкость, приготовленная с соблюдением всех технологий, значительно увеличит срок службы аккумулятора и убережет от опасного осыпания пластин внутри батареи.
- Электролит (аккумуляторный)
Электролит (аккумуляторный)
Электролит (аккумуляторный) — смесь серной кислоты с дистиллированной водой для заливки в свинцово-кислотную аккумуляторную батарею.
Электролит для заливки в свинцово-кислотную аккумуляторную батарею готовят из серной кислоты (ГОСТ 667—73) и дистиллированной воды (ГОСТ 6709—72). При подготовке электролита следует пользоваться руководством по эксплуатации автомобиля. Для надежной работы аккумуляторных батарей необходима высокая степень чистоты электролита.
Нельзя применять техническую серную кислоту и недистиллированную воду, так как при этом ускоряются саморазрядка, сульфатация и разрушение пластин, и уменьшается емкость.
Смешивать электролит следует в кислотостойкой эбонитовой, фарфоровой или освинцованной посуде.
Как приготовить электролит
Инструменты и материалы:
Приготовление:- Возьмите емкость, устойчивую к действию серной кислоты, залейте туда дистиллированную воду.
- Затем в заполненную дистиллированной водой емкость, маленькими порциями влейте серную кислоту, помешивая эбонитовой палочкой.
- Ни в коем случае не вливайте дистиллированную воду в серную кислоту, т.к. электролит будет разбрызгиваться с выделение большого количества тепла и в результате чего вы можете получить серьезные ожоги.
- Электролит готовится исходя из климатических условий местности. Для районов с умеренным климатом плотность электролиты должна быть — 1,28 г/см, т.е. для его изготовления вам нужно смешать компоненты в пропорции 0,36 л. серной кислоты на 1 л. дистиллированной воды.
- В теплых районах плотность электролита должна составлять 1,26 г/см, для подготовки берут 0,33 л. серной кислоты и 1 литр дистиллированной воды.
- Готовый электролит оставьте на 15—20 часов в закрытой емкости для его остывания, и чтобы произошло выпадение осадка на дно емкости.
Wikimedia Foundation. 2010.
- Электроклуб
- Электромагнитная плита
Смотреть что такое «Электролит (аккумуляторный)» в других словарях:
Электролит (химия) — Электролит химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты проводники второго рода,… … Википедия
Электролиты — Электролит химический термин, обозначающий вещество, расплав или раствор которого проводит электрический ток вследствие диссоциации на ионы. Примерами электролитов могут служить кислоты, соли и основания. Электролиты проводники второго рода,… … Википедия
Secret of Monkey Island — The Secret of Monkey Island Разработчик LucasArts Издатель LucasArts Дизайнер Рон Гилберт Дата выпуска … Википедия
The Secret Of Monkey Island — Разработчик LucasArts Издатель LucasArts Дизайнер Рон Гилберт Дата выпуска … Википедия
ОЖОГИ ПИЩЕВОДА ХИМИЧЕСКИЕ — мед. Химические ожоги пищевода вызывают концентрированные щёлочи и кислоты. Причины. Случайный или преднамеренный (с суицидальной целью) приём внутрь концентрированных кислот (уксусная эссенция, аккумуляторный электролит) или щелочей (нашатырный… … Справочник по болезням
корпус аккумулятора — банка аккумулятора корпус аккумулятора аккумуляторный сосуд — [Я.Н.Лугинский, М.С.Фези Жилинская, Ю.С.Кабиров. Англо русский словарь по электротехнике и электроэнергетике, Москва, 1999 г.] корпус Контейнер в котором находятся компоненты… … Справочник технического переводчика
Какая плотность электролита должна быть в аккумуляторе
Добраться до электролита, измерить плотность и отрегулировать показатель можно только в обслуживаемых аккумуляторах. Они изготавливаются по технологии WET или иначе мокрых банок. Представляют собой пластиковый корпус, поделенный на 6 отсеков (банок). В отсеках находятся пакеты пластин, залитые электролитом. Каждая банка это отдельный маленький аккумулятор напряжением 2,1 вольт, соединённые последовательно. Поэтому на крайних контактах в сумме получается 12,5 – 12,6 В. Сверху отсеки закрыты крышкой с пробками. Через эти пробки можно контролировать состояние электролита. Внешне всё выглядит как пластиковая коробка с ручкой, пробками и двумя контактами плюс и минус.
Залитые свинцово – кислотные батареи до сих пор остаются самыми распространёнными АКБ (аккумуляторными батареями). Их используют в легковых и гольф автомобилях, газонокосилках и другой садовой технике, грузовиках и на водном транспорте. Имеют две отличительные особенности – низкую цену и необходимость обслуживания. В составе электролита никаких секретов нет, это водный раствор обыкновенной серной кислоты h3SO4.
Показатель плотности измеряют в весе одного кубического сантиметра раствора. В продаже имеется электролит для заливки плотностью — 1,28 г/см3 и так называемый, корректирующий — 1,33. Для изготовления электролита плотностью 1,28 при температуре 25 °С смешивают 0,285 мл кислоты с 0,781 лм дистиллированной воды.
Оптимальная плотность очень важна для стабильной и долговечной работы аккумулятора. Она зависит от уровня заряда и температуры окружающей среды при измерении. Достоверные данные можно получить только на полностью заряженной батарее с температурой электролита 25 °С.
Немаловажным фактором являются условия эксплуатации. Для жаркого и холодного климата используют батареи с различной плотностью. В условия Крайнего Севера при сильных морозах она должна быть 1,3 и снижаться до 1,23 в жарком климате при высокой температуре. Это связано с поведением электролита при различных температурах. На морозе он должен не замерзнуть и не закипеть в жару. Для эксплуатации в средних климатических условиях допускается плотность 1,27 полностью заряженной АКБ. На разряженной показатель снижается до 1,11 и ниже.
Как проверить плотность электролита аккумулятора
Обслуживаемые АКБ требуют повышенного внимания. Они склонны к выкипанию и разбрызгиванию электролита. Плотность в банках может разнонаправленно меняться. Поэтому замеры необходимо проводить через каждые 15 – 20 тыс. км пробега или весной и осенью.
Для измерения необходим ареометр, очки, резиновые или силиконовые перчатки и старая одежда. Электролит очень агрессивен. В зависимости от чувствительности, при попадании на кожу его можно не почувствовать. А вот глаза и слизистые оболочки нужно беречь. Попадание на одежду на первый взгляд незаметно. Но даже небольшие капли проявят себя. После стирки обнаружатся большие и маленькие дырки на любимых джинсах, рубашке или куртке.
Ареометр – единственный прибор для измерения плотности электролита. Состоит из стеклянной колбы с помещенным внутрь денсиметром. Сверху находится резиновая груша. Денсиметр, это запаянная стеклянная трубка с металлическими шариками в нижней части и утончённым верхом. В утонченной части расположена шкала.
Для измерения нужно открутить пробки. Нажать на грушу и поместить в заливное отверстие кончик ареометра. Отпустить грушу и набрать электролит до всплывания денсиметра. Он не должен касаться донышка и стенок колбы. Ареометр нужно держать в вертикальном положении. Денсиметр будет плавать, на плотность укажет шкала на уровне электролита. Предварительный замер укажет на состояние аккумулятора. Обычно крайние банки разряжены сильнее и плотность в них меньше средних. После замера надо проверить уровень электролита, если необходимо долить дистиллированную воду.
Состояние батареи можно оценить только полностью зарядив её. Заряжаем АКБ и даём отдохнуть пару часов. Зарядка сопровождается кипением и повышением температуры электролита. Для достоверного замера газы должны выйти, температура упасть. После остывания можно проводить измерение. В зависимости от этих результатов можно сделать выводы о состоянии АКБ.
Таблица плотности электролита в аккумуляторе
Состояние можно оценить сопоставив плотность и напряжение аккумулятора, это делают руководствуясь данными таблицы:
|
Плотность электролита, г/см3 |
Напряжение без нагрузки, В |
Напряжение под нагрузкой 100 А, В |
Уровень заряда, % |
|
1,11 |
11,7 |
8,4 |
0 |
|
1,12 |
11,75 |
8,5 |
6 |
|
1,13 |
11,8 |
8,6 |
12 |
|
1,14 |
11,85 |
8,8 |
19 |
|
1,15 |
11,9 |
9 |
25 |
|
1,16 |
12 |
9,2 |
31 |
|
1,17 |
12 |
9,3 |
37 |
|
1,18 |
12,1 |
9,4 |
44 |
|
1,19 |
12,2 |
9,6 |
50 |
|
1,2 |
12,25 |
9,7 |
56 |
|
1,21 |
12,3 |
9,9 |
62 |
|
1,22 |
12,35 |
10 |
69 |
|
1,23 |
12,4 |
10,2 |
75 |
|
1,24 |
12,47 |
10,3 |
81 |
|
1,25 |
12,5 |
10,5 |
87 |
|
1,26 |
12,6 |
10,6 |
94 |
|
1,27 |
Не менее 12,66 |
10,8 |
100 |
Не всегда возможно создать идеальные условия для зарядки и измерения плотности электролита. В большинстве случаев применяют поправки. Для этого пользуются таблицей приведения полученных измерений.
|
Температура электролита от и до, °С |
Температурная поправка, г/см3 |
|
+ 47 + 50 |
+ 0,02 |
|
+ 33 + 46 |
+ 0,01 |
|
+ 18 + 32 |
0 |
|
+ 4 + 17 |
— 0,01 |
|
+ 3 – 10 |
— 0,02 |
|
– 11 – 25 |
— 0,03 |
|
– 26 – 39 |
-0,04 |
|
– 40 – 50 |
-0,05 |
На что влияет плотность электролита в аккумуляторе
Отрицательно влияют на аккумулятор колебания плотности в обе стороны.
При повышенной бурный химический процесс ведет к выкипанию воды и разрушению пластин. Необходимо постоянно доливать дистиллированную воду. Срок эксплуатации АКБ резко снижается.
Низкая затрудняет пуск двигателя, а при отрицательной температуре электролит может попросту замерзнуть. В теплый период года затруднения можно не заметить, но зимой стартер не сможет прокрутить двигатель. Электролит плотностью 1,11 замерзает при температуре всег лишь — 10 °С. Аккумулятор с пониженной плотностью полностью не заряжается, что провоцирует сульфатацию пластин.
Соблюсти баланс помогает утвердившаяся практика использования электролита различной плотности в зависимости от климата:
- Очень холодный и в условиях Крайнего Севера 1,3
- Умеренный климат — большая часть РФ от 1,26 до 1,27
- Южные районы страны от 1,23 до 1,25
- Минимально возможное значение 1,23 г/см3
Как следствие, ненормированная плотность приводит к преждевременной сдаче аккумулятора в утиль.
Как поднять плотность электролита
Первое, что необходимо сделать — попробовать поднять плотность полностью зарядив аккумулятор. Открыть пробки, при необходимости долить дистиллированной воды и подключить зарядное устройство. Полная зарядка может привести к следующим результатам:
- Плотность во всех банках одинакова.
- Во всех ниже нормы.
- Различается более на 0,1 г/см3 и более.
В первом случае каких либо действий не требуется.
Во втором случае потребуется специфическая зарядка. На поверхности свинцовых пластин уже хорошо потрудившихся аккумуляторов откладывается сульфат свинца. В таком состоянии батарею невозможно зарядить полностью. Её необходимо разрядить и провести зарядку импульсным устройством автоматически переключив его на Десульфатацию.
Обычным устройством это сделать труднее и процесс длится дольше. Для этого на 2 часа установить ток зарядки в 1/10 от ёмкости АКБ. Например для аккумулятора 65 Ач, ток зарядки выставить 6,5 А. После этого снизить ток до 2 А и заряжать 8 – 12 часов. Дать отстояться батарее до комнатной температуры измерить плотность. Если не пришла в норму, опять разрядить и провести ступенчатую зарядку.
Десульфатация обычно проводится в два – три цикла. Отрицательный результат говорит о том, что с АКБ придётся расстаться. Можно ещё попробовать полностью слить электролит, промыть дистиллированной водой и залить новый. Но этого обычно хватает ненадолго.
В третьем случае, когда плотность в банках разница более чем на 0,1 надо попробовать провести десульфатацию. Не помогло – откорректировать. Для этого приобрести корректирующий электролит плотностью 1,33 – 1,4 и дистиллированную воду. В банках с ненормальной плотностью откачать по 20 мл электролита. Для повышения добавить корректирующий, для снижения дистиллят. Зарядить 30 минут, дать отстояться ещё полчаса и замерить. Скорее всего к успеху приведут несколько корректировок.
Усилия ни к чему не приведут, а аккумулятор окажется непригоден при буром цвете электролита. В этом случае можно не предпринимать никаких действий.
Не сильно изношенным аккумуляторам десульфатация и корректировка значительно продлевает жизнь. Если усилия не увенчались успехом, то с батарей нужно расстаться немедленно и без сожаления. Иначе непредвиденный отказ станет неприятным сюрпризом.
Срок службы АКБ при условии соблюдения элементарных правил до пяти лет. В автомобиле нужно контролировать напряжение, не допускать чрезмерного и нулевого заряда батареи. Периодически заряжать и следить за плотностью электролита. При таком отношении аккумулятор служит долго и безотказно.
Определение, функции, дисбаланс и источники
Электролиты участвуют во многих важных процессах в вашем организме.
Они играют роль в проведении нервных импульсов, сокращении мышц, поддержании гидратации и регулировании уровня pH вашего тела (1, 2, 3, 4).
Следовательно, вам нужно получать достаточное количество электролитов из своего рациона, чтобы ваше тело функционировало должным образом.
В этой статье подробно рассматриваются электролиты, их функции, риск дисбаланса и возможные источники.
«Электролит» — это общий термин для частиц, которые несут положительный или отрицательный электрический заряд (5).
В питании этот термин относится к основным минералам, содержащимся в вашей крови, поте и моче.
Когда эти минералы растворяются в жидкости, они образуют электролиты — положительные или отрицательные ионы, используемые в обменных процессах.
Электролиты, найденные в вашем организме, включают:
Эти электролиты необходимы для различных процессов в организме, включая правильную работу нервов и мышц, поддержание кислотно-щелочного баланса и поддержание вашей гидратации.
Резюме Электролиты — это минералы, которые несут электрический заряд. Они содержатся в вашей крови, моче и поте и жизненно важны для определенных процессов, которые поддерживают ваше тело в должном порядке.
Электролиты имеют решающее значение для поддержания вашей нервной системы и мышц и сбалансированной внутренней среды.
Функция нервной системы
Ваш мозг посылает электрические сигналы через нервные клетки для связи с клетками по всему телу.
Эти сигналы называются нервными импульсами, и они генерируются в результате изменений электрического заряда мембраны нервных клеток (6).
Изменения происходят из-за движения натрия электролита через мембрану нервных клеток.
Когда это происходит, он запускает цепную реакцию, перемещая больше ионов натрия (и изменение заряда) по длине аксона нервной клетки.
Функция мышц
Кальций электролита необходим для сокращения мышц (7).
Позволяет мышечным волокнам скользить и перемещаться друг над другом, когда мышцы сокращаются и сокращаются.
Магний также необходим в этом процессе, чтобы мышечные волокна могли скользить наружу, а мышцы могли расслабиться после сокращения.
Надлежащая гидратация
Вода должна храниться в нужном количестве как внутри, так и снаружи каждой клетки вашего тела (8).
Электролиты, особенно натрий, помогают поддерживать баланс жидкости посредством осмоса.
Осмос — это процесс, при котором вода проходит через стенку клеточной мембраны из разбавленного раствора (больше воды и меньше электролитов) в сторону более концентрированного раствора (меньше воды и больше электролитов).
Это предотвращает переполнение или усыхание клеток из-за обезвоживания (9).
Внутренние уровни pH
Чтобы оставаться здоровым, ваше тело должно регулировать свой внутренний pH (10).
pH — это показатель кислотности или щелочности раствора. В вашем теле это регулируется химическими буферами или слабыми кислотами и основаниями, которые помогают минимизировать изменения в вашей внутренней среде.
Например, ваша кровь находится на уровне около 7.От 35 до 7,45. Если это отклоняется от этого, ваше тело не может функционировать должным образом, и вы плохо себя чувствуете.
Правильный баланс электролитов имеет основополагающее значение для поддержания уровня pH крови (10).
Резюме Электролиты необходимы для поддержания нервной системы и работы мышц. Они также обеспечивают оптимальную внутреннюю среду вашего тела, поддерживая ее гидратацию и помогая регулировать ваш внутренний рН.
В некоторых случаях уровень электролита в крови может стать слишком высоким или низким, что приведет к дисбалансу (11, 12, 13).
Нарушения электролитов могут оказать вредное воздействие на ваше здоровье и даже в некоторых случаях привести к летальному исходу (14).
Электролитный дисбаланс часто возникает из-за обезвоживания, вызванного избыточным нагреванием, рвотой или диареей. Вот почему вы должны помнить о замене любых потерянных жидкостей, когда жарко или когда вы больны (15).
Некоторые заболевания, в том числе болезни почек, расстройства пищевого поведения и травмы, такие как сильные ожоги, также могут вызывать дисбаланс электролитов (16, 17, 18, 19).
Если у вас слабое электролитное нарушение, у вас, вероятно, не будет никаких симптомов.
Однако более серьезные дисбалансы могут вызывать такие симптомы, как (20, 21):
- Усталость
- Быстрое или нерегулярное сердцебиение
- Онемение и покалывание
- Путаница
- Мышечная слабость и судороги
- Головные боли
- Судороги
000 Если вы подозреваете, что у вас электролитный дисбаланс, обязательно обсудите свои симптомы с врачом.
Резюме Дисбаланс электролитов чаще всего возникает, когда люди сильно обезвожены из-за рвоты, диареи или чрезмерного потоотделения. Серьезные дисбалансы могут помешать функционированию вашего тела.
Когда вы потеете, вы теряете как воду, так и электролиты, особенно натрий и хлорид.
В результате длительные физические нагрузки или физические нагрузки, особенно в жару, могут привести к значительной потере электролита.
По оценкам, пот содержит в среднем около 40–60 ммоль натрия на литр (22).
Но фактическое количество электролитов, потерянных с потом, может варьироваться от человека к человеку (23, 24).
В США максимальное рекомендуемое потребление натрия составляет 2300 мг в день, что эквивалентно 6 г или 1 чайной ложке поваренной соли (25).
Поскольку около 90% взрослых американцев потребляют намного больше, чем это, большинству людей не нужно заменять потерю натрия из-за пота (26).
Тем не менее, некоторые группы населения, такие как выносливые спортсмены, которые занимаются более двух часов, или те, кто тренируется в условиях сильной жары, могут захотеть пить спортивные напитки, обогащенные электролитом, чтобы компенсировать свои потери (27).
Для всех остальных достаточно получить нормальное количество натрия из пищи и питьевой воды, чтобы оставаться гидратированным.
Резюме Вы теряете воду и электролиты, особенно натрий, когда потеете. Тем не менее, натрия, потребляемого в вашем рационе, обычно достаточно, чтобы покрыть любые потери.
Лучший способ достичь и поддерживать электролитный баланс — это здоровое питание.
Основными пищевыми источниками электролитов являются фрукты и овощи. Однако в западной диете распространенным источником натрия и хлорида является поваренная соль.
Ниже приведены некоторые продукты, содержащие электролиты (28, 29, 30):
- Натрий: Маринованные продукты, сыр и поваренная соль.
- Хлорид: Соль поваренная.
- Калий: Фрукты и овощи, такие как бананы, авокадо и сладкий картофель.
- Магний: Семена и орехи.
- Кальций: Молочные продукты, обогащенные молочные продукты и зеленые листовые овощи.
Электролиты, такие как бикарбонат, естественным образом вырабатываются в вашем организме, поэтому вам не нужно беспокоиться о включении их в свой рацион.
Резюме Электролиты содержатся во многих продуктах, включая фрукты, овощи, молочные продукты, орехи и семена.
Некоторые люди пьют электролитную воду или добавки с электролитами, такими как натрий и кальций, чтобы обеспечить их достаточным количеством.
Однако, сбалансированной диеты, которая включает источники электролитов, должно быть достаточно для большинства.
Ваше тело обычно может эффективно регулировать электролиты и поддерживать их на нужном уровне.
Но в некоторых обстоятельствах, например, во время приступов рвоты и диареи, когда потери электролита чрезмерны, может быть полезным добавление раствора для регидратации, содержащего электролиты (31).
Количество, которое вам нужно будет потреблять, будет зависеть от ваших потерь. Всегда читайте инструкции по внебиржевым решениям по замене.
Также обратите внимание, что если у вас низкий уровень электролитов из-за чрезмерных потерь, то добавка может вызвать ненормальный уровень и, возможно, болезнь (32).
Лучше всего проконсультироваться с врачом или фармацевтом, прежде чем добавлять электролиты.
Резюме Если вы придерживаетесь сбалансированной диеты, содержащей хорошие источники электролитов, то добавление в нее обычно не требуется.
Электролиты — это минералы, которые несут электрический заряд при растворении в воде.
Они жизненно необходимы для вашей нервной системы, мышц и поддержания оптимальной среды тела.
Большинство людей удовлетворяют свои потребности в электролите с помощью сбалансированной диеты, хотя дисбаланс может возникнуть, если вы обезвожены из-за болезни или из-за перегрева.
Если вы подозреваете, что у вас электролитный дисбаланс, поговорите с врачом.
Если вы покупаете что-то по ссылке на этой странице, мы можем получить небольшую комиссию. Как это работает
Электролит — это вещество, которое проводит электричество при растворении в воде. Они необходимы для ряда функций организма.
Всем людям нужны электролиты, чтобы выжить. Многие автоматические процессы в организме зависят от небольшого электрического тока, и электролиты обеспечивают этот заряд.
Электролиты взаимодействуют друг с другом и клетками в тканях, нервах и мышцах.Баланс различных электролитов жизненно важен для здорового функционирования.
Быстрые факты об электролитах
- Электролиты жизненно важны для нормального функционирования человеческого организма.
- Фрукты и овощи являются хорошими источниками электролитов.
- Общие электролиты включают натрий, калий, кальций и бикарбонат.
- Симптомы электролитного дисбаланса могут включать в себя подергивание, слабость и, если не проверено, судороги и нарушения ритма сердца.
- Пожилые люди особенно подвержены риску нарушения электролитного баланса.
Электролиты — это химические вещества, которые проводят электричество при смешивании с водой.
Они регулируют нервные и мышечные функции, увлажняют организм, балансируют кислотность и давление крови и помогают восстановить поврежденные ткани.
Мышцы и нейроны иногда называют «электрическими тканями» тела. Они зависят от движения электролитов через жидкость внутри, снаружи или между элементами.
Электролиты в организме человека включают:
- натрий
- калий
- кальций
- бикарбонат
- магний
- хлорид
- фосфат
Например, мышце необходим кальций, натрий и калий для сокращения.Когда эти вещества становятся неуравновешенными, это может привести к мышечной слабости или чрезмерному сокращению.
Сердце, мышцы и нервные клетки используют электролиты для передачи электрических импульсов к другим клеткам.
Уровень электролита в крови может стать слишком высоким или слишком низким, что приведет к дисбалансу. Уровень электролита может меняться в зависимости от уровня воды в организме, а также других факторов.
Важные электролиты теряются в поту во время тренировок, включая натрий и калий.На концентрацию также может влиять быстрая потеря жидкости, например, после приступа диареи или рвоты.
Эти электролиты должны быть заменены для поддержания здорового уровня. Почки и несколько гормонов регулируют концентрацию каждого электролита. Если уровень вещества слишком высок, почки отфильтровывают его от тела, и различные гормоны действуют, чтобы сбалансировать уровни.
Дисбаланс представляет проблему для здоровья, когда концентрация определенного электролита становится выше, чем организм может регулировать.
Низкий уровень электролитов также может повлиять на общее состояние здоровья. Наиболее распространенные дисбалансы натрия и калия.
Симптомы электролитного дисбаланса
Симптомы будут зависеть от того, какой электролит не сбалансирован и является ли уровень этого вещества слишком высоким или слишком низким.
Вредная концентрация магния, натрия, калия или кальция может вызывать один или несколько из следующих симптомов:
- нерегулярное сердцебиение
- слабость
- костных нарушений
- подергивания
- изменения кровяного давления
- спутанность сознания
- судороги
- онемение
- расстройства нервной системы
- чрезмерная усталость
- судороги
- мышечный спазм
Может также возникнуть избыток кальция, особенно у пациентов с раком молочной железы, раком легких и множественной миеломой.Этот тип избытка часто вызван разрушением костной ткани.
Признаки и симптомы избыточного кальция могут включать в себя:
- частое мочеиспускание
- нерегулярное сердцебиение
- вялость
- усталость
- капризность и раздражительность
- тошнота
- боль в животе
- рвота
- крайняя мышечная слабость
- жажда
- сухость во рту или в горле
- полная потеря аппетита
- кома
- спутанность сознания
- запор
Поскольку эти симптомы также могут возникать в результате лечения рака или рака, иногда бывает трудно определить высокий уровень кальция в первом случае.
Существует несколько причин электролитного дисбаланса, в том числе:
- болезни почек
- не восполнение электролитов или сохранение гидратации после физической нагрузки
- длительных периодов рвоты или диареи
- плохое питание
- тяжелое обезвоживание
- дисбаланс кислотно-щелочной, или доля кислот и щелочей в организме
- застойная сердечная недостаточность
- лечение рака
- некоторые лекарства, такие как диуретики
- булимия
- возраст, так как почки пожилых людей становятся менее эффективными со временем
Электролитная панель используется для проверки дисбаланса электролитов в крови и измерения кислотно-щелочного баланса и функции почек.Этот тест также может контролировать ход лечения, связанный с известным дисбалансом.
Врач иногда включает электролитную панель как часть обычного физического обследования. Это может быть выполнено отдельно или как часть ряда тестов.
Уровни измеряются в миллимолях на литр (ммоль / л) с использованием концентрации электролитов в крови.
Людям часто дают электролитную панель во время пребывания в больнице. Это также делается для тех, кто доставлен в отделение неотложной помощи, так как острые и хронические заболевания могут влиять на уровень.
Если уровень отдельного электролита окажется слишком высоким или слишком низким, врач продолжит проверять этот дисбаланс до тех пор, пока уровень не вернется к норме. Если обнаружен кислотно-щелочной дисбаланс, врач может провести анализы газов крови.
Они измеряют уровни кислотности, кислорода и углекислого газа в пробе крови из артерии. Они также определяют степень дисбаланса и то, как человек реагирует на лечение.
Уровнитакже можно проверить, если врач назначит определенные препараты, которые, как известно, влияют на концентрацию электролита, такие как диуретики или ингибиторы АПФ.
Поделиться на PinterestOne решение для слабого электролитного дисбаланса включает в себя просто пить больше воды.Лечение электролитного дисбаланса включает либо восстановление уровней, если они слишком низкие, либо снижение концентраций, которые слишком высоки.
Если уровни слишком высоки, лечение будет зависеть от причины превышения. Низкие уровни обычно лечат добавлением необходимого электролита. Различные добавки с электролитом доступны для покупки онлайн.
Тип лечения также будет зависеть от тяжести дисбаланса.Иногда безопасно, чтобы уровни электролита индивидуума пополнялись с течением времени без постоянного мониторинга.
Однако симптомы могут иногда быть серьезными, и человек может нуждаться в госпитализации и наблюдении во время лечения.
Терапия пероральной регидратации
Эта процедура используется главным образом для людей, испытывающих дефицит электролита наряду с дегидратацией, обычно после тяжелой диареи.
Всемирная организация здравоохранения (ВОЗ) одобрила решение для использования в оральной регидратационной терапии, которое содержит:
- 2.6 г (г) натрия
- 1,5 г хлорида калия
- 2,9 г цитрата натрия
Их растворяют в 1 л (л) воды и вводят перорально.
Заместительная терапия электролитом
В более серьезных случаях нехватки электролита вещество можно вводить человеку либо перорально, либо внутривенно (в / в).
Нехватка натрия, например, может быть дополнена инфузией раствора морской воды или сложного лактата натрия.
Избыток может произойти, если организм теряет воду без потери электролитов. В этих случаях дается раствор воды и сахара в крови, или глюкозы.
Предотвращение
Некоторые причины нехватки электролита, такие как заболевание почек, не могут быть предотвращены. Тем не менее, хорошо управляемая диета может помочь снизить риск нехватки. Потребление умеренного количества спортивного напитка после физической нагрузки или физической нагрузки может помочь ограничить влияние потери электролитов в поту.
Для людей, которым не требуется пребывание в больнице, врач может порекомендовать изменения в рационе питания или добавки, чтобы сбалансировать концентрации электролита.
Когда уровень электролита слишком низок, важно включить продукты, которые содержат большое количество вещества. Вот несколько источников пищи для каждого из основных электролитов:
| Необходим электролит | Источники |
| Натрий | Укроп маринованный томатный сок 90 соусов 90 902 90 соусов, 90 соусов, 90 соусов и супов |
| Хлорид | томатные соки, соусы и супы салат оливки столовая соль |
| Калий | картофель с кожурой обычный йогурт банан |
| кальций | йогурт молоко рикотта зелень шпинат капуста сардины |
Важно иметь в виду, сколько каждого электролита содержится в пище.Министерство сельского хозяйства США (USDA) предлагает полезный ресурс для проверки питательности пищевых продуктов.
Добавкитакже являются опцией для управления низким уровнем электролита. Например, пожилые люди часто не потребляют достаточное количество калия, и уровни могут также снижаться при лечении кортикостероидами или мочегонными препаратами. В этих случаях таблетки калия могут повысить концентрацию в крови.
Поделиться на PinterestSports напитки могут помочь восполнить потерянные электролиты, но слишком частое их употребление может привести к избытку.Некоторые спортивные напитки, гели и конфеты были рекомендованы для пополнения уровня электролитов во время и после тренировок. Они помогают восстановить потерянные натрий и калий и сохранить воду.
Однако эти напитки, как правило, содержат большое количество электролита, и чрезмерное потребление может привести к избытку. Многие также содержат высокий уровень сахара.
Важно постоянно следовать любым предлагаемым курсам приема электролитов и придерживаться рекомендованного плана лечения.
Рекомендуемое потребление
Потребление правильного количества несбалансированного электролита должно привести к улучшению симптомов. Если этого не произойдет, могут потребоваться дополнительные тесты для выявления любых других основных условий, которые могут вызвать дисбаланс.
Обычное потребление некоторых из наиболее распространенных электролитов:
| Электролит | Рекомендуемое потребление в миллиграммах (мг) | Рекомендуемое потребление для людей старше 50 лет (мг) | Рекомендуемая доза для людей в возрасте старше 70 лет |
| натрия | 1500 | 1300 | 1200 |
| Калий | 4700 | — | — |
| кальция | 1 000 | 1 200 | — |
| Магний | 320 для мужчин, 420 для женщин | — | — |
Электролиты являются важной частью химического состава человека, d Дисбаланс может повлиять на регулярную функцию.Если вы чувствуете слабость после тренировки, это может быть причиной.
Регулярный мониторинг и потребление электролитов после интенсивных тренировок или обильного потоотделения может помочь сохранить уровень. Будьте уверены, чтобы оставаться увлажненным в любое время.
Электролиты — это химические вещества, которые распадаются на ионы (ионизируются) при растворении в воде. Положительно заряженные ионы называются катионами , а отрицательно заряженные ионы называются анионами . Вещества можно классифицировать как s сильные электролиты , слабые электролиты или неэлектролиты .
Сильные электролиты


Сильные электролиты полностью ионизируются в воде. Это означает, что 100% растворенного химического вещества распадается на катионы и анионы. Однако это не означает, что химическое вещество полностью растворяется в воде! Например, некоторые виды мало растворимы в воде, но являются сильными электролитами. Это означает, что не очень много растворяется, но все, что растворяется, распадается на ионы. Примером является гидроксид стронция с сильным основанием, Sr (OH) 2 . Обладает низкой растворимостью в воде, но полностью диссоциирует на ионы Sr 2+ и OH — .В то время как колба с гидроксидом натрия (NaOH) в воде будет содержать в воде ионы Na + и OH — , но без действительного NaOH, колба с водным гидроксидом стронция будет содержать ионы Sr 2+ и OH — Sr (OH) 2 и вода.
Примеры : Сильные кислоты, сильные основания и соли являются сильными электролитами.
Слабые электролиты


Слабые электролиты частично ионизируются в воде.Практически любая диссоциация на ионы между 0% и 100% делает химическое вещество слабым электролитом, но на практике около 1-10% слабого электролита распадается на ионы.
Примеры : Слабые кислоты и слабые основания являются слабыми электролитами. Большинство азотсодержащих молекул являются слабыми электролитами. В некоторых источниках вода считается слабым электролитом, поскольку она частично диссоциирует на ионы H + и OH — , но не является электролитом других источников, потому что только очень небольшое количество воды диссоциирует на ионы.
Неэлектролиты
Если вещество вообще не ионизируется в воде, это неэлектролит.
Примеры : Большинство соединений углерода являются неэлектролитами. Жиры, сахара и спирты в основном неэлектролиты.
Почему вы должны заботиться?
Самая важная причина узнать, является ли химическое вещество электролитом или нет и насколько сильно он диссоциирует в воде, заключается в том, что вам нужна эта информация для определения химических реакций, которые могут происходить в воде.Кроме того, если у вас есть контейнер с химическим веществом в воде, это хороший план, чтобы узнать, растворяется ли это вещество в воде (его растворимость) и распадается ли оно на ионы.
Классическим примером того, почему это важно, является раствор цианида натрия (NaCN). Вы, вероятно, знаете, что цианид является реактивным и чрезвычайно токсичным, поэтому вы бы открыли бутылку с цианидом натрия в воде? Если вы признаете, что цианид натрия является солью, вы будете знать, что вы в безопасности (при условии, что вы не пьете раствор), потому что в воде нет цианида натрия, только Na + и CN — в воде. ,Цианид-ионы не являются летучими и не заставят вас заболеть. Сравните это с бутылкой цианистого водорода (HCN) в воде. Вы бы открыли эту бутылку? Если вы узнаете, что цианистый водород является слабой кислотой, вы поймете, что в баллоне содержится газообразный цианистый водород, ионы водорода, ионы цианида и вода. Открытие этой бутылки может стоить вам жизни!
Как вы знаете, какие химические вещества электролиты?
Теперь, когда вы хотите узнать, что такое электролит, вы, вероятно, задаетесь вопросом, как определить, к какому типу электролита относится химическое вещество, исходя из его названия или структуры.Вы делаете это в процессе устранения. Вот некоторые шаги, чтобы следовать, чтобы идентифицировать сильные, слабые и не электролиты.
- Это сильная кислота? Их всего 7, и вы часто сталкиваетесь с ними в химии, поэтому стоит запомнить их. Сильные кислоты — сильный электролит.
- Это сильная база? Это немного большая группа, чем сильные кислоты, но вы можете определить сильные основания, потому что они являются гидроксидами металлов. Любой элемент из первых двух столбцов периодической таблицы в сочетании с гидроксидом является сильным основанием.Сильные основания — сильные электролиты.
- Это соль? Соли являются сильными электролитами.
- Содержит ли химическая формула азот или N? Это может быть слабое основание, что сделало бы его слабым электролитом.
- Химическая формула начинается с водорода или «Н»? Это может быть слабая кислота, которая сделает его слабым электролитом.
- Это углеродное соединение? Большинство органических соединений неэлектролиты.
- Это ничего из вышеперечисленного? Есть большая вероятность, что это неэлектролит, хотя это может быть слабый электролит.
Таблица сильных электролитов, слабых электролитов и неэлектролитов
В этой таблице приведены группы сильных, слабых и неэлектролитов с примерами для каждой категории.
| Сильные электролиты | ||||||||
| Сильные кислоты | HCl (соляная кислота) | |||||||
| HBr (бромистоводородная кислота) | ||||||||
| H001010 3 (азотная кислота) | ||||||||
| HClO 3 | ||||||||
| HClO 4 | ||||||||
| H 2 SO 4 (серная кислота) | 904 0904 (гидроксид натрия) | |||||||
| KOH (гидроксид калия) | ||||||||
| LiOH | ||||||||
| Ba (OH) 2 | ||||||||
| Ca (OH) 2 901 901 0908 0 | NaCl | |||||||
| KBr | ||||||||
| MgCl 2 | ||||||||
| Слабая электро Lytes | ||||||||
| слабые кислоты | HF (фтористоводородная кислота) | |||||||
| HC 2 H 3 O 2 (уксусная кислота) | ||||||||
| H 2 (углекислота) | ||||||||
| H 3 PO 4 (фосфорная кислота) | ||||||||
| слабые основания | NH 3 (аммиак) | |||||||
| (соединения «N») | C 5 H 5 N (пиридин) | |||||||
| Неэлектролиты | ||||||||
| Сахара и углеводы | C 6 H 12 O 6 (глюкоза) | холестерин | ||||||
| спирты | C 2 H 5 OH (этиловый спирт) | |||||||
| другие углеродные соединения | C 5 H 12 (ручка Tane) |
Гипокалиемия — это уровень калия в сыворотке <3,5 мг-экв / л. Клинические проявления обычно наблюдаются, только если уровень калия в сыворотке составляет <3,0 мг-экв / л, и включают мышечную слабость, изменения ЭКГ, нарушения ритма сердца, рабдомиолиз и почечные нарушения. Гипокалиемия может возникать в результате снижения потребления калия, увеличения поступления калия в клетки, увеличения выведения калия (например, из желудочно-кишечного тракта, через мочу или пот), диализа или плазмафереза.Возможные причины включают хронический алкоголизм, нервную анорексию, гипокалорийные белковые диеты для быстрого похудения [11], Liu T, Nagami GT, Everett ML, et al. Очень низкокалорийные диеты и гипокалиемия: важность выведения аммония. Nephrol Dial Трансплантация. 2005 март; 20 (3): 642-6. https://academic.oup.com/ndt/article/20/3/642/1870537 http://www.ncbi.nlm.nih.gov/pubmed/15735248?tool=bestpractice.com метаболический или респираторный алкалоз или ацидоз почечных канальцев, гипотермия, рвота, тяжелая диарея, [12] Rose BD, Post TW.Клиническая физиология кислотно-основных и электролитных нарушений. 5-е изд. Нью-Йорк, Нью-Йорк: McGraw-Hill; 2001: 836-56. первичный альдостеронизм, солеотверждающиеся нефропатии, занятия спортом в жарком климате, [13] Годек С.Ф., Годек Дж.Дж., Бартолоцци А.Р. Состояние гидратации у футболистов колледжа в течение последовательных дней предсезонных тренировок два раза в день. Am J Sports Med. 2005 июн; 33 (6): 843-51. http://www.ncbi.nlm.nih.gov/pubmed/15827364?tool=bestpractice.com муковисцидоз, [14] Dave S, Honney S, Raymond J, et al.Необычное проявление муковисцидоза у взрослого человека. Am J Kidney Dis. 2005 март; 45 (3): e41-4. http://www.ncbi.nlm.nih.gov/pubmed/15754262?tool=bestpractice.com гипомагниемия, полиурия, гипокалиемический периодический паралич, ожоги и другие дерматологические состояния. Некоторые лекарства могут вызывать гипокалиемию, включая диуретики, лечение инсулином при диабетическом кетоацидозе или некетотической гипергликемии, бета-адренергические агонисты, такие как альбутерол или тербуталин, теофиллин, хлорохин, слабительное злоупотребление или использование средства для очистки кишечника, а также введение витамина B12 или фолиевой кислоты в мегалобластная анемия.[12] Роза BD, Пост TW. Клиническая физиология кислотно-основных и электролитных нарушений. 5-е изд. Нью-Йорк, Нью-Йорк: McGraw-Hill; 2001: 836-56.
